
Wetenschap
Hoeveel atomen zitten er in 1 g waterstofgas?
1. Inzicht in de structuur van waterstofgas
* Waterstofgas bestaat als een diatomisch molecuul (H₂), wat betekent dat twee waterstofatomen aan elkaar binden.
2. Molaire massa
* De molaire massa waterstofgas (H₂) is ongeveer 2 g/mol (1 g/mol per waterstofatoom x 2 atomen).
3. Berekening van mollen
* Verdeel de massa waterstofgas door zijn molaire massa om het aantal mol te vinden:
* Mol h₂ =1 g / 2 g / mol =0,5 mol
4. Avogadro's nummer
* Het nummer van Avogadro vertelt ons het aantal deeltjes (atomen, moleculen, enz.) In één mol van een stof. Het is ongeveer 6.022 x 10²³ deeltjes/mol.
5. Atomen berekenen
* Vermenigvuldig het aantal mol waterstofgas met het nummer van Avogadro om het aantal H₂ -moleculen te vinden:
* Aantal H₂ moleculen =0,5 mol * 6.022 x 10²³ Moleculen/mol =3,011 x 10²³ Moleculen
* Aangezien elk H₂ -molecuul 2 waterstofatomen bevat, vermenigvuldigt u het aantal moleculen met 2 om het totale aantal waterstofatomen te krijgen:
* Aantal waterstofatomen =3.011 x 10²³ Moleculen * 2 atomen/molecuul = 6.022 x 10²³ Atomen
Daarom zijn er ongeveer 6,022 x 10²³ waterstofatomen in 1 gram waterstofgas.
 Wat zijn de resulterende producten van het splitsen van water bij fotosynthese?
Wat zijn de resulterende producten van het splitsen van water bij fotosynthese?  Hoe heten de elementen die aanwezig zijn in zoutzuur?
Hoe heten de elementen die aanwezig zijn in zoutzuur?  Wetenschappers laten zien hoe vloeibare brandstoffen in polymere gels kunnen worden opgeslagen om explosies en branden te voorkomen
Wetenschappers laten zien hoe vloeibare brandstoffen in polymere gels kunnen worden opgeslagen om explosies en branden te voorkomen  Waar worden metalen en niet -metalen gevonden in de periodiek systeem?
Waar worden metalen en niet -metalen gevonden in de periodiek systeem?  Wat is het woordvergelijking, evenals evenwichtige chemische stof van lood II nitraat en natriumjodide?
Wat is het woordvergelijking, evenals evenwichtige chemische stof van lood II nitraat en natriumjodide?
 Hoe 'wetenschapspopularisatoren' de publieke opinie over religie beïnvloeden
Hoe 'wetenschapspopularisatoren' de publieke opinie over religie beïnvloeden  Brandbranden en huizen beschermen tegen bosbranden:vlammend door de wind opgeblazen puin begrijpen
Brandbranden en huizen beschermen tegen bosbranden:vlammend door de wind opgeblazen puin begrijpen Overproductie bedreigt superfoodparadijs in Andes
Overproductie bedreigt superfoodparadijs in Andes Snowkyo 2020:organisatoren in Tokio testen nepsneeuw om Olympische Spelen te koelen
Snowkyo 2020:organisatoren in Tokio testen nepsneeuw om Olympische Spelen te koelen Welk zeebioom wordt gekenmerkt door diepe waterdiepten die nooit zonlicht ontvangen?
Welk zeebioom wordt gekenmerkt door diepe waterdiepten die nooit zonlicht ontvangen?
Hoofdlijnen
- Wat is een blaas?
- Is mitochondria gebruikelijk in pro-eukaryotische cellen?
- Bio-ingenieurs ontdekken mechanisme dat krachtpatsers van cellen reguleert
- Welke cellaag ontwikkelen laterale wortels?
- Wat voor soort symbiotische relatie heeft de Saguaro?
- In stedelijke stromen, farmaceutische vervuiling stimuleert microbiële resistentie
- Onderzoekers ontdekken hoe ‘cryptische soorten’ anders reageren op koraalverbleking
- Nieuwe inzichten in hoe vasculaire netwerken zich vormen in de hersenen van vissen
- Kunnen wetenschappers plantaardig voedsel produceren, net als een blad kan?
- Onderzoekers produceren een biocel die even effectief is als een platina-brandstofcel

- Chemicus synthetiseert nieuwe verbindingen met sterke antidiabetische eigenschappen
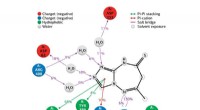
- Hoe de eerste biomoleculen gevormd konden zijn

- Chemische verbinding produceert gunstige ontstekingen, remyelinisatie die kan helpen bij de behandeling van MS
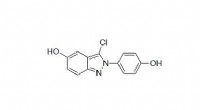
- Wetenschappers ontwikkelen een materiaal voor gebruik in stralingstolerante apparaten

 Online wantrouwen bestrijden:nieuw onderzoek legt uit waarom de huidige berichteninspanningen mogelijk niet effectief zijn
Online wantrouwen bestrijden:nieuw onderzoek legt uit waarom de huidige berichteninspanningen mogelijk niet effectief zijn  Wat is een geërfde autosomale recessieve aandoening van het bloed waarin een persoon geen enzym ontbreekt dat nodig is om aminozuurfenylalanine af te breken, breekt dan chemicaliën?
Wat is een geërfde autosomale recessieve aandoening van het bloed waarin een persoon geen enzym ontbreekt dat nodig is om aminozuurfenylalanine af te breken, breekt dan chemicaliën?  Welk woordvergelijking vat de hydrolyse van een koolhydraat samen?
Welk woordvergelijking vat de hydrolyse van een koolhydraat samen?  De bron van watervervuiling identificeren met synthetisch DNA-zand
De bron van watervervuiling identificeren met synthetisch DNA-zand Computervaardigheden aanleren door middel van gamen
Computervaardigheden aanleren door middel van gamen Wat waren de ontdekkingen van Albert Einstein?
Wat waren de ontdekkingen van Albert Einstein?  Ingenieurs uit Illinois beschermen artefacten door grafeenvergulding
Ingenieurs uit Illinois beschermen artefacten door grafeenvergulding Naar welk element behoort de fosfor?
Naar welk element behoort de fosfor?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

