
Wetenschap
Is loodhydroxide oplosbaar in water?
Dit is waarom:
* Regels voor oplosbaarheid: Algemene oplosbaarheidsregels geven aan dat hydroxiden van zware metalen meestal * onoplosbaar * in water zijn.
* evenwicht: Hoewel een kleine hoeveelheid loodhydroxide zal oplossen, bereikt de oplossing een evenwicht waar het grootste deel van het loodhydroxide blijft als een vaste stof.
* pH -afhankelijkheid: De oplosbaarheid van loodhydroxide is pH-afhankelijk. Het is meer oplosbaar in zure oplossingen vanwege de reactie met H+ -ionen om oplosbare loodionen te vormen (Pb²⁺).
Samenvattend: Hoewel technisch niet volledig onoplosbaar, wordt loodhydroxide voor de meeste doeleinden praktisch als praktisch onoplosbaar beschouwd.
 Wat is de chemische formule voor citroensiroop?
Wat is de chemische formule voor citroensiroop?  Onderzoekers kwantificeren thermodynamisch samenspel tijdens co-aggregatie van eiwitten
Onderzoekers kwantificeren thermodynamisch samenspel tijdens co-aggregatie van eiwitten Waarom kan vloeibaar water op aarde bestaan?
Waarom kan vloeibaar water op aarde bestaan?  Wat dronken ze? Onderzoekers onderzoeken radioactieve crockpots
Wat dronken ze? Onderzoekers onderzoeken radioactieve crockpots  Klein, snel, en zeer energiezuinig geheugenapparaat geïnspireerd op lithium-ionbatterijen
Klein, snel, en zeer energiezuinig geheugenapparaat geïnspireerd op lithium-ionbatterijen
 Hoe kan schimmel groeien op brood?
Hoe kan schimmel groeien op brood?  Europa houdt klimaatverandering vanuit de ruimte in de gaten
Europa houdt klimaatverandering vanuit de ruimte in de gaten Science Activities on Air for Preschool Ages
Science Activities on Air for Preschool Ages Wat kunnen architecten doen, nu 66 miljoen mensen zonder goede huisvesting leven?
Wat kunnen architecten doen, nu 66 miljoen mensen zonder goede huisvesting leven?  Indonesië-expert gewaarschuwd voor aardbeving door de overheid in kaart gebrachte risicogebieden
Indonesië-expert gewaarschuwd voor aardbeving door de overheid in kaart gebrachte risicogebieden
Hoofdlijnen
- Welk organelle bevel alle celfuncties?
- Losse huid en slap volume beschermen Hagfish tegen haaienbeten
- Waarom ademen mensen op de planeet Aarde?
- AI-tool maakt synthetische afbeeldingen van cellen voor verbeterde microscopieanalyse
- Het drie domeinenysteem ontstond toen wetenschappers organismen gegroepeerd hebben op basis van hoe lang ze zijn geweest?
- Wat zijn drie verschillen tussen oomycetes en schimmels?
- Hoe overleef je een massale uitsterving?
- Wat wat zijn sekschromosomen?
- De 'stille code' van eiwitten beïnvloedt de manier waarop cellen bewegen
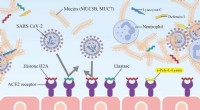
- Nieuwe sleutelbescherming tegen COVID-19 gevonden in speeksel
- Nieuwe microscopie werkt bij extreme hitte, werpt licht op legeringen voor kernreactoren

- Röntgenexperimenten dragen bij aan studies van een medicijn dat nu is goedgekeurd om tuberculose te bestrijden

- De leiding nemen:onderzoekers werken samen om betere batterijen te maken

- Voor waterstofenergie, alledaagse materialen zijn misschien bijna net zo goed als prijzig platina

 Natuurkundigen breiden stochastische thermodynamica dieper uit in het kwantumterritorium
Natuurkundigen breiden stochastische thermodynamica dieper uit in het kwantumterritorium Onderzoekers fabriceren geminiaturiseerde bionische oceaanbatterij
Onderzoekers fabriceren geminiaturiseerde bionische oceaanbatterij Het perengenoom kraken:hoe studenten hielpen een nieuw hulpmiddel voor de industrie te ontsluiten
Het perengenoom kraken:hoe studenten hielpen een nieuw hulpmiddel voor de industrie te ontsluiten  Onderzoekers rapporteren nieuwe op botsingen gebaseerde computertechniek
Onderzoekers rapporteren nieuwe op botsingen gebaseerde computertechniek Hoe wordt een uniforme cirkelvormige beweging beloond door versnelde beweging?
Hoe wordt een uniforme cirkelvormige beweging beloond door versnelde beweging?  Worden tornado's sterker?
Worden tornado's sterker?  Lijst met Savanne-dieren
Lijst met Savanne-dieren Wat Google's quantum suprematie betekent voor de toekomst van computers
Wat Google's quantum suprematie betekent voor de toekomst van computers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

