
Wetenschap
Wanneer barium en zuurstof reageren om een ionische verbinding te vormen, verliezen atomen 2 elektronen een kation?
* barium (ba) is een alkalisch aardmetaal, gelegen in groep 2 van het periodiek systeem. Dit betekent dat het twee valentie -elektronen heeft (elektronen in de buitenste schaal).
* Oxygen (O) is een niet -metaal in groep 16, wat betekent dat het zes valentie -elektronen heeft. Het heeft nog twee elektronen nodig om een stabiel octet te bereiken (8 elektronen in de buitenste schaal).
De reactie:
Wanneer barium en zuurstof reageren, verliest barium zijn twee valentie -elektronen om een positief geladen ion (kation) te worden:
* ba → ba²⁺ + 2e⁻
Zuurstof wint deze twee elektronen en wordt een negatief geladen ion (anion):
* o + 2e⁻ → o²⁻
De resulterende ionen, ba²⁺ en o²⁻, hebben tegengestelde ladingen en trekken elkaar elektrostatisch aan, vormen de ionische verbinding bariumoxide (BAO) .
Key Takeaway: Barium verliest twee elektronen om een +2 kation te vormen, terwijl zuurstof twee elektronen krijgt om een -2 anion te vormen. Dit is een klassiek voorbeeld van ionische binding.
 Goede plaatsen om lege aluminium blikjes te vinden
Goede plaatsen om lege aluminium blikjes te vinden Wanneer een waterige oplossing van zilvernitraat en natriumchloride wordt gemengd. Welk neerslag wordt onmiddellijk gevormd?
Wanneer een waterige oplossing van zilvernitraat en natriumchloride wordt gemengd. Welk neerslag wordt onmiddellijk gevormd?  Waarom hebben vaste stoffen een duidelijke vorm terwijl vloeistoffen bergafwaarts stromen en gassen door hun containers bewegen?
Waarom hebben vaste stoffen een duidelijke vorm terwijl vloeistoffen bergafwaarts stromen en gassen door hun containers bewegen?  Waarom kan water niet worden gebruikt in plaats van olie om het halfgeleiderspecimen te dopen?
Waarom kan water niet worden gebruikt in plaats van olie om het halfgeleiderspecimen te dopen?  Onderzoekers stimuleren bloedvatvorming met suiker
Onderzoekers stimuleren bloedvatvorming met suiker
 Common House Spiders en hun paring-habits
Common House Spiders en hun paring-habits Een nieuwe kijk op de grote lenteschoonmaak-waanzin:hoe het bewaren van oude dingen op zijn eigen manier 'vreugde kan opwekken'
Een nieuwe kijk op de grote lenteschoonmaak-waanzin:hoe het bewaren van oude dingen op zijn eigen manier 'vreugde kan opwekken'  Plantaanpassingen in de toendra
Plantaanpassingen in de toendra  Olielozingen hebben de kust van Californië ontsierd en haar politiek gevormd
Olielozingen hebben de kust van Californië ontsierd en haar politiek gevormd Aardbeving treft het Indonesische eiland Bali, maar geen slachtoffers
Aardbeving treft het Indonesische eiland Bali, maar geen slachtoffers
Hoofdlijnen
- Wat is acetylcholinesteresce?
- Waarom is evolutie een wet en natuurlijke selectietheorie?
- Welke wetenschappelijke basiskennis is essentieel voor de productie van medicijnen?
- Een beter reservoirbeheer zou de voedselzekerheid en het behoud van de visserij in de VS kunnen bevorderen
- Waarom is DNA bijna altijd een rechtsdraaiende helix? Onderzoek naar de oorzaken van chiraliteit
- Wat zijn larvale voedselplanten?
- Onderzoekers tonen aan dat koralen moeite hebben om te groeien onder meerdere stressfactoren
- AI-aangedreven virtuele rat biedt inzicht in hoe hersenen complexe, gecoördineerde bewegingen controleren
- Wat is wetenschappelijk proza?
- Onderzoekers creëren onmogelijke eiwitkooien van nanoformaat met behulp van goud
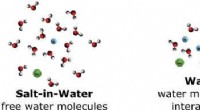
- Hooggeconcentreerde waterige elektrolyten kunnen de in batterijen gebruikte oplosmiddelen vervangen
- Een nieuwe kijk op brillen

- Onderzoekers upgraden organische zonnecellen voor gebruik in dakpannen die stroom opwekken
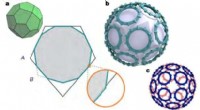
- Een superatoom synthetiseren:deuren openen voor hun gebruik als vervanging voor elementaire atomen

 Hoe oud is die vingerafdruk?
Hoe oud is die vingerafdruk? Chandra-waarnemingen geven inzicht in jonge stellaire cluster NGC 3293
Chandra-waarnemingen geven inzicht in jonge stellaire cluster NGC 3293 Improvisatiepedagogiek ondersteunt de sociale vaardigheden van alle soorten leerlingen
Improvisatiepedagogiek ondersteunt de sociale vaardigheden van alle soorten leerlingen Burgerastronomen over de hele wereld werken samen voor wereldrecordonderzoek naar een nabije aardse asteroïde
Burgerastronomen over de hele wereld werken samen voor wereldrecordonderzoek naar een nabije aardse asteroïde Nieuw type investering kan financieringskloof voor klimaatadaptatieprojecten verkleinen
Nieuw type investering kan financieringskloof voor klimaatadaptatieprojecten verkleinen  Heeft chloor een hoger kookpunt dan jodium?
Heeft chloor een hoger kookpunt dan jodium?  Waterwegen van Chicago - die na meer dan 100 jaar nog steeds stromen
Waterwegen van Chicago - die na meer dan 100 jaar nog steeds stromen 31,3 mm gelijk hoeveel centimeter en berekent u dit antwoord?
31,3 mm gelijk hoeveel centimeter en berekent u dit antwoord?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

