
Wetenschap
Bereken de massa vaste vaste stof die nodig is om 100 ml oplossing te maken die 1,0 m in natriumkation is met behulp van chloride?
1. Bepaal de formule van het chloridezout
Omdat we een 1,0 m oplossing van natriumkationen (Na+) willen, is het chloridezout dat we zullen gebruiken natriumchloride (NaCl) .
2. Bereken de molaire massa van NaCl
* NA:22,99 g/mol
* CL:35.45 g/mol
* Molaire massa van NaCl =22,99 + 35.45 =58,44 g/mol
3. Bereken de mol NaCl nodig
* Molariteit (m) =mol opgeloste stof / liters oplossing
* We willen een 1,0 m oplossing en 100 ml (0,1 L) oplossing.
* mol NaCl =molariteit x volume =1,0 m x 0,1 l =0,1 mol
4. Bereken de benodigde massa NaCl
* massa =mollen x molaire massa
* massa =0,1 mol x 58,44 g/mol =5,844 g
Daarom zou u 5.844 gram natriumchloride (NaCl) nodig hebben om een oplossing van 100 ml te maken die 1,0 m in natriumkation is.
 Hoe breken CFK's de ozonlaag af?
Hoe breken CFK's de ozonlaag af?  Wat is een fermionisch condensaat?
Wat is een fermionisch condensaat?  Subtiele veranderingen in de chemische structuur kunnen de toxiciteit van geneesmiddelen beïnvloeden
Subtiele veranderingen in de chemische structuur kunnen de toxiciteit van geneesmiddelen beïnvloeden Wat is de elektronenconfiguratie in de grondtoestand van een neutraal mangaanatoom?
Wat is de elektronenconfiguratie in de grondtoestand van een neutraal mangaanatoom?  Welke heeft de grootste elektronegativiteit Xenon stikstof of lithium?
Welke heeft de grootste elektronegativiteit Xenon stikstof of lithium?
Hoofdlijnen
- Welk gespecialiseerd eiwit bestaat in het neurale celmembraan?
- Hoe E. coli de kracht krijgt om urineweginfecties te veroorzaken
- Wie kan profiteren van klimaatverandering? Ratelslangen, suggereert onderzoek
- Kunnen door de bloedbaan reizen en cellen beïnvloeden in het verre deel van het lichaam?
- Wetenschappers ontdekken fossielen van gigantische zeehagedis die 66 miljoen jaar geleden over de oceanen heerste
- Wat is de tak van de wetenschap die de mens vergelijkt met biosystemen?
- Nieuw genomisch onderzoek biedt een glimp van hoe walvissen zich kunnen aanpassen aan de oceaan
- Welke activiteit zou de coördinatie van beide hersenen van de hemisferen vereisen?
- Hoe beïnvloedt genetische recombinatie hoe soorten in de loop van de tijd veranderen?
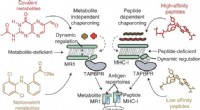
- Onderzoekers ontdekken moleculaire basis van antigeenverwerking voor kankerdoelwit MR1
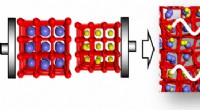
- Gebruikmaken van geometrische frustratie om batterijen af te stemmen voor meer vermogen
- Handheld spectrale analysator verandert smartphone in diagnostisch hulpmiddel

- Depressie, zwaarlijvigheid, chronische pijn kan worden behandeld door zich op hetzelfde belangrijke eiwit te richten
- Doorbraak in lignine-onderzoek - bolvormige deeltjes vermenigvuldigen de enzymefficiëntie

 Een genetische opstand in het vroege leven voorkomen
Een genetische opstand in het vroege leven voorkomen Wat zijn de functies van Triglyceride Phospholipid & Sterol?
Wat zijn de functies van Triglyceride Phospholipid & Sterol?  Er is meer aandacht nodig voor de manier waarop het bestaande internationale recht de toenemende militarisering van de ruimte kan voorkomen, zegt het onderzoek
Er is meer aandacht nodig voor de manier waarop het bestaande internationale recht de toenemende militarisering van de ruimte kan voorkomen, zegt het onderzoek  Nieuwe techniek laat wetenschappers in nanodeeltjes kijken zie atomaire structuur in 3-D
Nieuwe techniek laat wetenschappers in nanodeeltjes kijken zie atomaire structuur in 3-D Een zeer goedkope zelfgemaakte fotovoltaïsche zonnecel maken
Een zeer goedkope zelfgemaakte fotovoltaïsche zonnecel maken Wordt de klimaattransitie een strijd om materialen?
Wordt de klimaattransitie een strijd om materialen?  Zijn alle moleculen van het leven op koolstof gebaseerd?
Zijn alle moleculen van het leven op koolstof gebaseerd?  Nieuw-Zeeland stopt nieuwe offshore olie- en gasexploratie
Nieuw-Zeeland stopt nieuwe offshore olie- en gasexploratie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

