
Wetenschap
Welke heeft de grootste elektronegativiteit Xenon stikstof of lithium?
* elektronegativiteit is het vermogen van een atoom om elektronen naar zichzelf aan te trekken in een chemische binding.
* Trends in elektronegativiteit:
* verhoogt over een periode (van links naar rechts): Atomen worden kleiner en hebben een sterkere greep op hun elektronen.
* vermindert een groep (van boven naar beneden): Atomen worden groter en hun valentie -elektronen zijn verder van de kern, waardoor ze minder aangetrokken worden.
Laten we eens kijken naar de posities van de elementen:
* xenon (xe): Groep 18 (edelgas), periode 5. Nobele gassen hebben een zeer lage elektronegativiteit.
* stikstof (n): Groep 15, periode 2.
* lithium (li): Groep 1, periode 2.
Gebaseerd op de trends:
* Stikstof zal een hogere elektronegativiteit hebben dan lithium omdat het verder rechts in de periodiek systeem is.
* Zowel stikstof als lithium zullen een hogere elektronegativiteit hebben dan Xenon, wat een edelgas is.
Daarom heeft stikstof (N) de grootste elektronegativiteit uit de drie elementen.
 Nieuwe gegevens van passagiers laten zien hoe het openbaar vervoer de uitstoot van broeikasgassen en vervuilende stoffen vermindert
Nieuwe gegevens van passagiers laten zien hoe het openbaar vervoer de uitstoot van broeikasgassen en vervuilende stoffen vermindert Met dik ijs verdwenen, Arctisch zee-ijs verandert langzamer
Met dik ijs verdwenen, Arctisch zee-ijs verandert langzamer Verschillende bronnen van water
Verschillende bronnen van water  Hoe mensen vogelgemeenschappen op eilanden transformeren
Hoe mensen vogelgemeenschappen op eilanden transformeren  Wat is een stormvloed en waarom is deze zo gevaarlijk?
Wat is een stormvloed en waarom is deze zo gevaarlijk?
Hoofdlijnen
- Wat is een adaptief voordeel voor het beperken van DNA in een kern?
- Wat is de naam van een plant die Fibonacci -nummers toont in aantal groeipunten die het heeft?
- Wat is het verschil in wetenschappelijke methode en een onwetenschappelijke methode?
- Nieuwe afbraakeiwitten tonen de route naar celoverleving
- Nieuwe bacteriesoort ontdekt in de darm
- Neurale opnames van wilde vleermuizen onthullen een unieke organisatie van het middenhersenengebied voor het volgen en vangen van prooien
- Wat maakt een allel dominant, recessief of mede-dominant?
- Wat is een voorbeeld van de functie nerveus weefsel?
- Waarom zou het schudden van genetisch materiaal om nieuwe combinaties van kenmerken te produceren voor een soort voordelig zijn en wanneer het schadelijk is?
- De nieuwste ontwikkeling van polymeeronderzoekers resulteert in een nieuwe beker die bestand is tegen kokende vloeistoffen

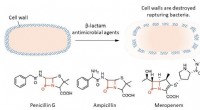
- Een nieuwe boosdoener in antibacteriële resistentie:cysteïnepersulfide
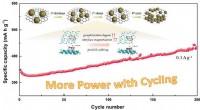
- Verfijning van deeltjes induceert en verhoogt de cycluscapaciteit van natrium/lithium-ionbatterijen
- Nieuwe routes voor de constructie van sterke metaal-ondersteuningsinteracties
- Microben die samenwerken vermenigvuldigen de conversiemogelijkheden van biomassa

 De gedragsaanpassingen van Giraffes
De gedragsaanpassingen van Giraffes Finnen willen op zoek naar resten Arctische meteoriet (Update)
Finnen willen op zoek naar resten Arctische meteoriet (Update) Is het leven begonnen in kleigrijze?
Is het leven begonnen in kleigrijze? Grenzen voorbij:onderzoek naar exotische nucleaire landschappen en hun kosmische implicaties
Grenzen voorbij:onderzoek naar exotische nucleaire landschappen en hun kosmische implicaties  Amazon belooft tegen 2040 klimaatneutraal te zijn
Amazon belooft tegen 2040 klimaatneutraal te zijn Wat zijn de effecten van opname- en verlieswater in dierlijke cellen?
Wat zijn de effecten van opname- en verlieswater in dierlijke cellen?  Wat hondeneigenaren moeten weten over leptospirose
Wat hondeneigenaren moeten weten over leptospirose  Slimmer ontwikkelen, snellere machine-intelligentie met licht
Slimmer ontwikkelen, snellere machine-intelligentie met licht
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

