
Wetenschap
Hoe zullen waterige oplossingen van sucrose en waterstofchloride verschillen?
sucrose (c₁₂h₂₂o₁₁)
* Moleculaire structuur: Sucrose is een disaccharide, een groot molecuul bestaande uit glucose- en fructose -eenheden.
* Oplosbaarheid: Het lost goed op in water vanwege de aanwezigheid van veel hydroxylgroepen (-OH) die waterstofbruggen met watermoleculen kunnen vormen.
* geleidbaarheid: Het is een niet-elektrolyt , wat betekent dat het niet dissocieert in ionen wanneer opgelost in water. Dit betekent dat het geen elektriciteit leidt.
* pH: Sucrose -oplossingen zijn neutraal (pH rond 7), omdat het niet bijdraagt aan de zuurgraad of basiciteit van de oplossing.
* Chemische reacties: Sucrose is relatief niet -reactief in waterige oplossing. Het kan worden gehydrolyseerd (afgebroken in glucose en fructose) door enzymen zoals sucrase, maar dit is geen typische reactie in een eenvoudige waterige oplossing.
waterstofchloride (HCl)
* Moleculaire structuur: HCL is een sterk zuur, bestaande uit een waterstofatoom dat is gebonden aan een chlooratoom.
* Oplosbaarheid: Het lost gemakkelijk op in water.
* geleidbaarheid: Het is een sterke elektrolyt , wat betekent dat het volledig ioniseert in water, het vormen van waterstofionen (H⁺) en chloride -ionen (CL⁻). Dit maakt zijn waterige oplossingen zeer geleidend.
* pH: HCL -oplossingen zijn zuur, met pH -waarden minder dan 7, vanwege de afgifte van H⁺ -ionen. De pH hangt af van de concentratie van HCl.
* Chemische reacties: HCL is zeer reactief in waterige oplossing. Het reageert gemakkelijk met bases om zouten en water te vormen. Het reageert ook met veel metalen om waterstofgas af te geven.
Samenvattend:
* Sucrose -oplossingen zijn neutraal , niet-geleidend , en relatief niet -reactief .
* HCL -oplossingen zijn zuur , Geleidend , en zeer reactief .
Deze verschillen komen voort uit het fundamentele verschil in hun chemische structuren en hun gedrag in waterige oplossing. Sucrose blijft als een molecuul, terwijl HCL dissocieert in ionen, wat leidt tot dramatische veranderingen in hun eigenschappen.
 Nieuwe technologie stuwt inspanningen om westerse bosbranden te bestrijden voort
Nieuwe technologie stuwt inspanningen om westerse bosbranden te bestrijden voort Erfgoedpotentieelkaart is bedoeld om stadsplanners te helpen de geschiedenis te behouden
Erfgoedpotentieelkaart is bedoeld om stadsplanners te helpen de geschiedenis te behouden Wat gebeurt er als vervuiling in de natuurlijke hulpbronnen van de aarde wordt?
Wat gebeurt er als vervuiling in de natuurlijke hulpbronnen van de aarde wordt?  Transformatieve verandering kan mens en natuur redden
Transformatieve verandering kan mens en natuur redden Grenzen overschrijden in het stroomgebiedbeheer van Louisiana
Grenzen overschrijden in het stroomgebiedbeheer van Louisiana
Hoofdlijnen
- Onderzoek levert aanwijzingen op waarom sommige ernstige infecties blijven bestaan
- Onderzoekers laten zien hoe opportunistische bacteriën concurrenten verslaan
- Het visfeest is in wezen een benzinestation en trekt zeeleeuwen naar Pier 39 in aantallen die in 15 jaar niet meer zijn gezien
- Wat zijn fossielen en wat vertellen ze ons over het evolutieproces?
- Leef snel, sterf jong:signaaldetectietheorie bijwerken
- Hoe geld en technologie de strijd tegen de illegale handel in wilde dieren militariseren
- Wat produceert een mix van fenotypes van ouders?
- Een analogie om uit te leggen waarom de celgrootte beperkt is?
- Denken dieren rationeel? Onderzoeker suggereert dat voor rationele besluitvorming geen taal nodig is
- Elektrisch neutraal radicaal:een sterk chemisch reductiemiddel bij blootstelling aan licht

- Nieuwe methode voor microbiële energieproductie ontdekt

- 3D-geprinte weefsels en organen zonder de steigers
- De kristalsymmetrie van de natuur onderbreken om gerichte medicijnafgifte te bevorderen
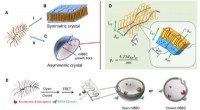
- Drugsspons kan bijwerkingen van kankerbehandeling minimaliseren
 Google verhoogt de ondersteuning voor het controleren van feiten over het coronavirus
Google verhoogt de ondersteuning voor het controleren van feiten over het coronavirus Welke dieren leven in het dennenbos?
Welke dieren leven in het dennenbos?  Ontdekking van nieuwe soorten microfossielen kan eeuwenoude wetenschappelijke vragen beantwoorden
Ontdekking van nieuwe soorten microfossielen kan eeuwenoude wetenschappelijke vragen beantwoorden Kwantumontdekking bevestigt een decennia-oude theorie over hoe monopolen vervallen
Kwantumontdekking bevestigt een decennia-oude theorie over hoe monopolen vervallen  Welke regio bevat de grootste verscheidenheid aan organismen?
Welke regio bevat de grootste verscheidenheid aan organismen?  Cellulose nanokristallen mogelijk groen wondermateriaal
Cellulose nanokristallen mogelijk groen wondermateriaal Hoeveel zuurstof is er nodig om een kaars te laten branden?
Hoeveel zuurstof is er nodig om een kaars te laten branden?  Welke betekenis heeft de lente-equinox in de astrologie?
Welke betekenis heeft de lente-equinox in de astrologie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

