
Wetenschap
Waarom wordt verwarming met koolstofextract koper uit oxide?
De chemie:
* koperoxide (cuo) is een verbinding waar koper een positieve lading heeft (+2).
* koolstof (c) is een goed reductiemiddel, wat betekent dat het gemakkelijk elektronen verliest.
* Wanneer verwarmd, reageert koolstof met koperoxide en neemt zuurstof uit het oxide. Dit vormt koolstofdioxide (CO2) .
* Het koper, nu zonder de zuurstof, wordt teruggebracht tot zijn elementaire vorm (Cu).
Reactievergelijking:
2Cuo + C → 2Cu + CO2
Waarom het werkt:
* Koolstofaffiniteit voor zuurstof: Koolstof heeft een hoge affiniteit voor zuurstof en vormt gemakkelijk koolstofdioxide.
* thermodynamica: De reactie is thermodynamisch gunstig, wat betekent dat het energie vrijgeeft en spontaan bij hoge temperaturen verloopt.
in eenvoudiger termen:
Stel je koolstof voor als een "dief" die de zuurstof "steelt" van koperoxide. Dit laat het koper achter in zijn pure vorm. De warmte biedt de energie voor de reactie.
Praktische toepassingen:
Deze reactie wordt gebruikt in de industriële extractie van koper uit zijn ertsen. De koolstofbron kan cola of houtskool zijn en de reactie vindt plaats in een oven bij hoge temperaturen.
Belangrijke opmerking: Dit is een vereenvoudigde verklaring. Het werkelijke proces van koper -extractie is complexer en omvat meerdere fasen. Het fundamentele principe van het gebruik van koolstof als reductiemiddel om koper uit het oxide te extraheren, blijft echter hetzelfde.
 Welke kleur krijgt rode kool als je alkali toevoegt?
Welke kleur krijgt rode kool als je alkali toevoegt?  Traditionele geheimen om koel te blijven - onderzoek naar Okinawa-textiel
Traditionele geheimen om koel te blijven - onderzoek naar Okinawa-textiel Wat is de reactiviteit van boor?
Wat is de reactiviteit van boor?  Ingrediënt in Indiase lange peper veelbelovend tegen hersenkanker in diermodellen
Ingrediënt in Indiase lange peper veelbelovend tegen hersenkanker in diermodellen Overlevingsstrategie:hoe één enzym bacteriën helpt herstellen van blootstelling aan antibiotica
Overlevingsstrategie:hoe één enzym bacteriën helpt herstellen van blootstelling aan antibiotica
 Welke koninkrijken zijn heterotrofisch en autotroof?
Welke koninkrijken zijn heterotrofisch en autotroof?  Natte winters mogen kleine bosbranden niet temperen
Natte winters mogen kleine bosbranden niet temperen Welke verklaring beschrijft het beste wetenschappers die hebben bijgedragen aan de huidige hoeveelheid wetenschappelijke kennis?
Welke verklaring beschrijft het beste wetenschappers die hebben bijgedragen aan de huidige hoeveelheid wetenschappelijke kennis?  Russische onderzoekers onderzoeken grote olieramp in de Zwarte Zee
Russische onderzoekers onderzoeken grote olieramp in de Zwarte Zee Sherpa-gids ontbreekt op Everest, vermoedelijk dood
Sherpa-gids ontbreekt op Everest, vermoedelijk dood
Hoofdlijnen
- Wat is de wetenschappelijke naam Ladybird?
- Bloedsicles en baden houden Filippijnse dierentuindieren koel als de hittegolf toeslaat
- Infectieziekten:CTRL + ALT + Delete
- Alleen structuren betrokken bij mitose van dierlijke cellen?
- Waarom is het belangrijk dat RNA kleiner is dan DNA?
- Zijn kenmerken en aanpassingen hetzelfde?
- Wat zijn dochtercellen geproduceerd wanneer ze mitose ondergaan, genetisch zijn?
- Hoe kan natuurlijke selectie leiden tot speciatie?
- Naar welke groep micro-organismen behoort gist?
- 3D-geprint materiaal ter vervanging van ivoor voor restauratie van artefacten

- Gasopslagmethode kan de volgende generatie schone energievoertuigen helpen

- Onderzoekers ontsluiten een nieuwe methode voor het testen van op eiwit gebaseerde medicijnen
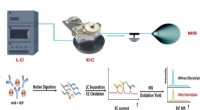
- In gloeiende kleuren:de verspreiding van medicijndeeltjes in een forensisch laboratorium zien

- Onderzoek toont aan hoe elektriciteitsetende microben elektronen gebruiken om koolstofdioxide te fixeren

 De straten heroveren? We kunnen allemaal inspraak hebben in het nieuwe normaal na het coronavirus
De straten heroveren? We kunnen allemaal inspraak hebben in het nieuwe normaal na het coronavirus Hoe lang is in centimeters 55 mm?
Hoe lang is in centimeters 55 mm?  Welke eigendom van materie ondersteunt verbranding?
Welke eigendom van materie ondersteunt verbranding?  Hoe vertonen cellen de 7 kenmerken van het leven?
Hoe vertonen cellen de 7 kenmerken van het leven?  Welke voorgestelde natuurlijke selectie om verandering in soorten te verklaren?
Welke voorgestelde natuurlijke selectie om verandering in soorten te verklaren?  Breedbladige bomen vertonen een verminderde gevoeligheid voor het broeikaseffect
Breedbladige bomen vertonen een verminderde gevoeligheid voor het broeikaseffect  Op bewijs gebaseerde tips om uw geheugen te verbeteren
Op bewijs gebaseerde tips om uw geheugen te verbeteren ORNL-microscopie onthult dansende siliciumatomen in grafeen
ORNL-microscopie onthult dansende siliciumatomen in grafeen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

