
Wetenschap
Zwaveldifluoride -ionische of covalente binding?
* elektronegativiteit: Fluor is zeer elektronegatief (wat betekent dat het sterk elektronen aantrekt) en zwavel is minder elektronegatief. Het verschil in elektronegativiteit tussen zwavel en fluor is significant, maar niet groot genoeg om ionische bindingen te vormen.
* Elektronen delen: Covalente bindingen vormen zich wanneer atomen elektronen delen om een stabiele elektronenconfiguratie te bereiken. In SF 2 , het zwavelatoom deelt elektronen met elk van de twee fluoratomen, waardoor een stabiel molecuul ontstaat.
Sleutelpunten:
* ionische bindingen: Vorm wanneer er een groot verschil is in elektronegativiteit, waardoor het ene atoom een elektron volledig van het andere neemt. Dit creëert ionen met tegengestelde ladingen die elkaar aantrekken.
* Covalente bindingen: Vorm wanneer atomen elektronen delen. Het delen kan gelijk zijn (niet -polair covalent) of ongelijk (polaire covalente), afhankelijk van het verschil in elektronegativiteit.
Sinds SF 2 omvat het delen van elektronen tussen zwavel en fluor, het heeft covalente bindingen.
 Anti-verouderingsmolecuul NAD+ krijgt een boost door het blokkeren van een enzym
Anti-verouderingsmolecuul NAD+ krijgt een boost door het blokkeren van een enzym Onderzoekers ontwikkelen nieuwe technologie die de commercialisering van brandstofcelvoertuigen kan versnellen
Onderzoekers ontwikkelen nieuwe technologie die de commercialisering van brandstofcelvoertuigen kan versnellen Natriumtjes wanneer toegevoegd aan water. Maar waarom natriumchloride bruiseren?
Natriumtjes wanneer toegevoegd aan water. Maar waarom natriumchloride bruiseren?  Wat zijn de items met pH van 7?
Wat zijn de items met pH van 7?  Hoe het PH-niveau in Water te verhogen
Hoe het PH-niveau in Water te verhogen
 VN vindt dat herpes miljoenen Iraakse karpers heeft gedood
VN vindt dat herpes miljoenen Iraakse karpers heeft gedood Wat is het onderliggende principe van alle verschillende sekten hindoeïsme?
Wat is het onderliggende principe van alle verschillende sekten hindoeïsme?  Waarom lijken wij mensen zo op elkaar maar toch anders?
Waarom lijken wij mensen zo op elkaar maar toch anders?  EPA trekt zich terug de handhaving van vervuilingsregels omdat virusstammen werken
EPA trekt zich terug de handhaving van vervuilingsregels omdat virusstammen werken Leven op de bodem van de Noordelijke IJszee, met strengheid en in detail
Leven op de bodem van de Noordelijke IJszee, met strengheid en in detail
Hoofdlijnen
- Waarom maakt het hebben van te veel opties het moeilijker om te kiezen?
- Hebben prokaryote cellen een aparte kern?
- Handelen of niet handelen? De ivoren impasse doorbreken
- Hoe bavianen gezonde familiegrenzen bewaken
- Welke twee hoofdprocessen waarmee plantencellen afgifte absorberen en energie gebruiken?
- Wat is de belangrijkste functie van ademhaling in levende organismen?
- Hoe is mitose van invloed op het leven?
- De drie dingen die de plant binnenkomen tijdens fotosynthese zijn?
- Nieuw onderzoek onthult hoe E. coli-cellen antibacteriële behandeling ontwijken
- Baanbrekende synthesestrategie kan een golf van nieuwe medicinale verbindingen betekenen
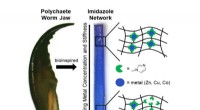
- Wetenschappers bootsen de dodelijke kaak van een worm na om veerkrachtige materialen te ontwerpen en te vormen
- Nieuw, niet-invasieve bloedsuikertestmethoden met speeksel

- Nieuwe reactie maakt indoline-steigers beschikbaar voor farmaceutische ontwikkeling

- Vlindervormig palladium subnano cluster gebouwd in 3-D
 Zelfrijdende auto's:waarom kunnen we niet verwachten dat ze moreel zijn?
Zelfrijdende auto's:waarom kunnen we niet verwachten dat ze moreel zijn? Als een object begint te versnellen?
Als een object begint te versnellen?  Honingbijen stemmen om te beslissen over nestplaatsen – waarom we zouden moeten luisteren
Honingbijen stemmen om te beslissen over nestplaatsen – waarom we zouden moeten luisteren  Wat zijn enkele niet-voorbeelden van elastische potentiële energie?
Wat zijn enkele niet-voorbeelden van elastische potentiële energie?  Waarom en hoe fungeert plasma tegelijkertijd als een vaste vloeistof?
Waarom en hoe fungeert plasma tegelijkertijd als een vaste vloeistof?  Wat is 8750 in wetenschappelijke notatie?
Wat is 8750 in wetenschappelijke notatie?  De bbp-fudge:China-editie
De bbp-fudge:China-editie Microrobots gewapend met nieuw krachtdetectiesysteem om cellen te onderzoeken
Microrobots gewapend met nieuw krachtdetectiesysteem om cellen te onderzoeken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

