
Wetenschap
Wat is de evenwichtige vergelijking van natriumfosfaat en magnesiumhydroxide?
2 na₃po₄ (aq) + 3 mg (oh) ₂ (aq) → mg₃ (po₄) ₂ (s) + 6 NaOH (aq)
Hier is een uitsplitsing van de reactie:
* reactanten:
* Natriumfosfaat (Na₃po₄) :Een oplosbare ionische verbinding die oplost in water om natrium (Na⁺) en fosfaat (PO₄³⁻) ionen te vormen.
* magnesiumhydroxide (mg (oh) ₂) :Een enigszins oplosbare ionische verbinding die oplost in water om magnesium (mg²⁺) en hydroxide (OH⁻) ionen te vormen.
* Producten:
* magnesiumfosfaat (mg₃ (po₄) ₂) :Een onoplosbare ionische verbinding die uit oplossing neerslaat als een vaste stof.
* Natriumhydroxide (NaOH) :Een oplosbare ionische verbinding die in de oplossing blijft opgelost als natrium (Na⁺) en hydroxide (OH⁻) ionen.
Verklaring van evenwicht:
* kationen: Er zijn 6 natriumionen (Na⁺) aan de reactantzijde en 6 aan de productzijde. Evenzo zijn er aan beide zijden 3 magnesiumionen (mg²⁺).
* anionen: Er zijn 2 fosfaationen (PO₄³⁻) aan beide zijden en 6 hydroxide -ionen (OH⁻) aan beide zijden.
Sleutelpunten:
* Deze reactie is een dubbele verplaatsing Reactie, waarbij de kationen en anionen van de reactanten van partners veranderen.
* De vorming van het onoplosbare magnesiumfosfaat (mg₃ (PO₄) ₂ ₂) is de drijvende kracht voor de reactie.
* De toestandssymbolen (aq) voor waterig, en (s) voor vaste stof, geven de fysieke toestand van elke stof in de reactie aan.
 Wat is de temperatuur bij welke lucht wordt verzadigd genoemd?
Wat is de temperatuur bij welke lucht wordt verzadigd genoemd?  Reageert natrium en kalium gewelddadig met water een chemische of fysieke verandering?
Reageert natrium en kalium gewelddadig met water een chemische of fysieke verandering?  Waarom zijn atomen van metalen en niet -reactief?
Waarom zijn atomen van metalen en niet -reactief?  Waarom vormen de elementen natrium- en kalium -ionen met dezelfde lading?
Waarom vormen de elementen natrium- en kalium -ionen met dezelfde lading?  Hoe wordt de evenwichtsconstante van een reactie bepaald?
Hoe wordt de evenwichtsconstante van een reactie bepaald?
 Wateren voor de kust van New England in het midden van een recordjaar voor warmte
Wateren voor de kust van New England in het midden van een recordjaar voor warmte Onderzoek wijst uit dat arseen tientallen jaren na het einde van de blootstelling kanker kan veroorzaken
Onderzoek wijst uit dat arseen tientallen jaren na het einde van de blootstelling kanker kan veroorzaken De brandstof van evolutie:een nieuwe hypothese over hoe complex leven op aarde ontstond
De brandstof van evolutie:een nieuwe hypothese over hoe complex leven op aarde ontstond  Wat leren leerlingen van klasse 7 in de wetenschap?
Wat leren leerlingen van klasse 7 in de wetenschap?  Wat zijn natuurlijke krachten die de aarde veranderen?
Wat zijn natuurlijke krachten die de aarde veranderen?
Hoofdlijnen
- Hoe inheemse verbranding de bossen van de Klamath Mountains een millennium lang heeft gevormd
- Wat zijn de drie soorten koolhydraten en wat gebruikt er?
- Op welke manier helpen aanpassingen het overleven van soorten?
- Waarom hebben planten eiwitten nodig voor groei?
- Onderzoekers breiden de kracht van genbewerking uit door een nieuwe klasse van DNA-basiseditors te ontwikkelen
- Het principe of de wet van de haarheid waarin staat dat alleen de dominante eigenschap in een organisme kan worden gezien, bevat genen een paar contrasterende eigenschappen wordt genoemd?
- Wat heeft ribosomen eraan bevestigd en synthetiseert eiwitten?
- Wat zijn feromen en hoe gebruiken insectenetende planten ze?
- Wat zijn de moleculen die deel uitmaken van DNA?
- Wetenschappers maken eerste biomoleculaire simulatie van miljarden atomen

- Nieuw ontwikkelde COVID-19-test detecteert en identificeert specifieke varianten met 100% nauwkeurigheid
- Gigantische moleculen in de vorm van Kandinsky-cirkels zijn giftig voor MRSA-bacteriën

- Nieuwe methode vereenvoudigt het zoeken naar eiwitreceptorcomplexen, de ontwikkeling van medicijnen versnellen

- Hoe klimaatveranderende koolstofdioxide om te zetten in plastic en andere producten?
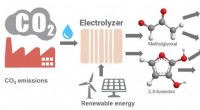
 Hoe snel moet een object de snelheid van het geluid doorbreken?
Hoe snel moet een object de snelheid van het geluid doorbreken?  Welke GCSE -optie zou het meest nuttig zijn als u naar natuurkunde wilde gaan, zoals Quantum Mechanics Computing, die in principe programmeren of astronomie kleine stukjes basis astrofysica heeft?
Welke GCSE -optie zou het meest nuttig zijn als u naar natuurkunde wilde gaan, zoals Quantum Mechanics Computing, die in principe programmeren of astronomie kleine stukjes basis astrofysica heeft?  Antibiotica beschermen appels tegen bacterievuur, maar vernietigen ze het inheemse microbioom?
Antibiotica beschermen appels tegen bacterievuur, maar vernietigen ze het inheemse microbioom?  Voor welk soort energie is een medium nodig?
Voor welk soort energie is een medium nodig?  Jongeren leren over relaties van media
Jongeren leren over relaties van media Een knuffel nodig tijdens de coronapandemie? Facebook heeft daar een nieuwe feelgood-reactie voor
Een knuffel nodig tijdens de coronapandemie? Facebook heeft daar een nieuwe feelgood-reactie voor Hoeveel energie moet worden toegevoegd aan een stuk goud van 1 kg met specifieke warmte 130 J/(kg ° C) verhoogt de temperatuur van 20 ° C 100 ° C?
Hoeveel energie moet worden toegevoegd aan een stuk goud van 1 kg met specifieke warmte 130 J/(kg ° C) verhoogt de temperatuur van 20 ° C 100 ° C?  Waarom kan pH niet onder 1 zijn?
Waarom kan pH niet onder 1 zijn?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

