
Wetenschap
Waarom reageert aluminium met drie broomatomen?
* valentie -elektronen: Aluminium (AL) heeft drie valentie -elektronen in zijn buitenste schaal, terwijl broom (BR) er zeven heeft. Aluminium wil deze drie elektronen verliezen om een stabiele octetconfiguratie te bereiken, terwijl Bromine één elektron wil krijgen om hetzelfde te bereiken.
* Elektrostatische aantrekkingskracht: Het verlies van elektronen door aluminium creëert een positief geladen aluminiumion (Al³⁺), terwijl broom een elektron wint om een negatief geladen bromide -ion te vormen (Br⁻). Deze tegengestelde ladingen trekken elkaar aan vanwege elektrostatische krachten.
* ionische binding: De sterke elektrostatische aantrekkingskracht tussen het positief geladen aluminiumion en de negatief geladen bromide -ionen resulteert in de vorming van een ionische binding.
* stabiliteit: Drie broomatomen zijn vereist om de +3 lading van het aluminiumion in evenwicht te brengen, wat resulteert in de vorming van aluminium bromide (Albr₃). Deze verbinding is stabiel vanwege de evenwichtige ladingen en de Octet -configuratie die wordt bereikt door alle betrokken atomen.
Samenvattend wordt de reactie tussen aluminium en broom aangedreven door het verlangen van beide elementen om een stabiele elektronenconfiguratie te bereiken. Dit leidt tot de vorming van een ionische verbinding, aluminium bromide (Albr₃), waarbij drie broomatomen binden met één aluminiumatoom.
 Cijfers leggen uit hoe en waarom West bakt, verbrandt en droogt uit
Cijfers leggen uit hoe en waarom West bakt, verbrandt en droogt uit Hoe verhouden actie en reactiekrachten zich tot het echte leven?
Hoe verhouden actie en reactiekrachten zich tot het echte leven?  Was Beethoven zwart? Een Twitter-meme onthult meer over ras en muziek dan de afkomst van de componist
Was Beethoven zwart? Een Twitter-meme onthult meer over ras en muziek dan de afkomst van de componist  Wetenschappers ontwikkelen nieuwe methode om het vroege leven in oude rotsen te bestuderen
Wetenschappers ontwikkelen nieuwe methode om het vroege leven in oude rotsen te bestuderen Twee verwoestende branden. Honderden kilometers van elkaar verwijderd. Een boosdoener:wind
Twee verwoestende branden. Honderden kilometers van elkaar verwijderd. Een boosdoener:wind
Hoofdlijnen
- Microbiologie vs. Biochemie
- Wat zijn catagorische gegevens?
- Ontdekt? Nieuw maar uitgestorven menselijk familielid uit Melanesië
- Wat zijn enkele cellen organismen zonder kernen zoals Escherichia coli die in het menselijk lichaam leven?
- Wat is een Siberisch wit Tigers -ecosysteem?
- Welke organen zijn bekleed met al het slijmvlies?
- Wat zijn de vezels die impulsen in de richting van neuroncellichaam dragen?
- Welk deel van de cel laat de cel verspillen?
- Welk organisme kwam na cyanobacteriën?
- Vloeistof-vloeistofovergangen kristalliseren nieuwe ideeën voor moleculaire vloeistoffen

- Antilichaam tegen kankerverwekkende stof ontcijferd

- Het visualiseren van de warmtestroom in bamboe kan helpen bij het ontwerpen van meer energie-efficiënte en brandveilige gebouwen

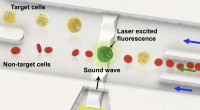
- Onderzoekers ontwikkelden sorteertechnologie op één celniveau met behulp van geluidsgolven
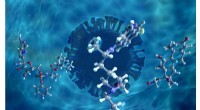
- Neutronen onderzoeken moleculair gedrag van voorgestelde COVID-19 kandidaat-geneesmiddelen
 Wat zijn gratis aannames van elektronentheorie?
Wat zijn gratis aannames van elektronentheorie?  De verrassende kracht van kleine gegevens - meer informatie is niet per se beter in de gezondheidszorg of het bedrijfsleven
De verrassende kracht van kleine gegevens - meer informatie is niet per se beter in de gezondheidszorg of het bedrijfsleven De grote conjunctie van 2020 is een hemelse gebeurtenis die 800 jaar in de maak is
De grote conjunctie van 2020 is een hemelse gebeurtenis die 800 jaar in de maak is  Wat is de gebruikelijke hoeveelheid zeebodemsedimenten op een bepaalde locatie?
Wat is de gebruikelijke hoeveelheid zeebodemsedimenten op een bepaalde locatie?  Label en identificeer de delen van de zon?
Label en identificeer de delen van de zon?  Welk mineraal bevat ijzer heeft een metalen glans is moeilijk en dezelfde kleurstreak?
Welk mineraal bevat ijzer heeft een metalen glans is moeilijk en dezelfde kleurstreak?  Stoppels brandende luchtvervuiling in India veroorzaakt economische verliezen van 30 miljard dollar, gezondheids risico's
Stoppels brandende luchtvervuiling in India veroorzaakt economische verliezen van 30 miljard dollar, gezondheids risico's Renault boekt recordverkopen als opvolger van Ghosn gezocht
Renault boekt recordverkopen als opvolger van Ghosn gezocht
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

