
Wetenschap
Hoe kun je zien of een verbinding reageert met broom?
Inzicht in de reactiviteit van broom
Bromine (Br₂) is een halogeen en een sterke elektrofiel. Dit betekent dat het gemakkelijk op zoek is naar en elektronenrijke gebieden in moleculen aanvalt. Hier leest u hoe u de vraag kunt benaderen:
1. Zoek naar onverzadigde verbindingen
* alkenes en alkynes: Deze verbindingen hebben respectievelijk dubbele of drievoudige bindingen van koolstofarbon. De elektronendichtheid in deze bindingen maakt ze vatbaar voor aanvallen door broom. De reactie resulteert in de toevoeging van broom over de dubbele of drievoudige binding, waardoor een dibromoalkaan of een dibromoalkeen wordt gevormd.
* aromatische verbindingen: Hoewel aromatische ringen relatief stabiel zijn, kunnen ze reageren met broom onder specifieke omstandigheden. De reactie vereist meestal een katalysator (zoals februari) om elektrofiele aromatische substitutie te initiëren, waarbij een waterstofatoom wordt vervangen door broom.
2. Identificeer de aanwezigheid van elektronenrijke locaties
* alcoholen: Het zuurstofatoom bij alcoholen heeft eenzame paren elektronen, waardoor het molecuul elektronrijk is. Dit kan leiden tot reactie met broom, maar het is minder gebruikelijk dan met alkenen of alkynes.
* Amines: Evenzo bevatten amines stikstof met alleenstaande paren, waardoor ze vatbaar zijn voor elektrofiele aanval door broom.
3. Overweeg de reactieomstandigheden
* licht: Sommige reacties met broom vereisen licht om het proces te initiëren. Dit geldt met name voor reacties met alkanen, die over het algemeen niet reactief zijn met broom in het donker.
* katalysator: Zoals vermeld, kan een katalysator zoals februari nodig zijn voor broom om te reageren met aromatische verbindingen.
* oplosmiddel: Het gebruikte oplosmiddel kan ook de reactiviteit van broom beïnvloeden.
Sleutelindicatoren van een reactie:
* Decolorisatie van broom: Bromine heeft een onderscheidende roodbruine kleur. Als broom wordt toegevoegd aan een oplossing en de kleur verdwijnt, is dit een goede indicatie dat er een reactie is opgetreden.
* Vorming van een neerslag: Sommige reacties met broom kunnen leiden tot de vorming van een vast neerslag.
* Warmte- of lichtemissie: Exotherme reacties kunnen warmte of licht afgeven tijdens het reactieproces.
Belangrijke opmerking: Niet alle verbindingen die dubbele of drievoudige bindingen bevatten, reageren met broom bij kamertemperatuur. Zeer vervangende alkenen of alkynes kunnen bijvoorbeeld minder reactief zijn.
Voorbeelden:
* ethene (c₂h₄) + br₂ → 1,2-dibromoethaan (c₂h₄br₂) (Snelle reactie, ontkleuring van broom)
* benzeen (c₆h₆) + br₂ (februari katalysator) → bromobenzeen (c₆h₅br) (Vereist een katalysator)
Laat het me weten als je een specifieke verbinding in gedachten hebt, en ik kan je helpen de reactiviteit ervan met broom te bepalen!
 Indicator die rood wordt in zure en blauwe alkali?
Indicator die rood wordt in zure en blauwe alkali?  Welke elementen zitten er in natriumcarbonaat?
Welke elementen zitten er in natriumcarbonaat?  Wat is nitraten NO3?
Wat is nitraten NO3?  Een innovatief proces voorkomt onomkeerbaar energieverlies in batterijen
Een innovatief proces voorkomt onomkeerbaar energieverlies in batterijen Wat is de methode van transport voor verplaatsing natriumionen in cel en kalium tussen plasma met rood bloed?
Wat is de methode van transport voor verplaatsing natriumionen in cel en kalium tussen plasma met rood bloed?
 De stroomstoringen in Californië kunnen de strijd tegen klimaatverandering nog moeilijker maken
De stroomstoringen in Californië kunnen de strijd tegen klimaatverandering nog moeilijker maken Wat is een derecho? Een atmosferische wetenschapper legt deze zeldzame maar gevaarlijke stormsystemen uit
Wat is een derecho? Een atmosferische wetenschapper legt deze zeldzame maar gevaarlijke stormsystemen uit Een woord om een klimaat met vochtige lucht te beschrijven?
Een woord om een klimaat met vochtige lucht te beschrijven?  Supertyfoon Chanthu bedreigt Filipijnen Taiwan
Supertyfoon Chanthu bedreigt Filipijnen Taiwan NASA-NOAA-satelliet vangt vorming van tropische cycloon Lili
NASA-NOAA-satelliet vangt vorming van tropische cycloon Lili
Hoofdlijnen
- Wat is de betekenis van endosporen?
- Kunnen we een echt Jurassic Park creëren?
- Hoe gebruik je een wetenschapper als een objectvulling?
- De genetische basis en het proces van inteeltdepressie bij een elite hybride rijst
- Wat bevatten lysosomen waarmee ze de cellen van de cellen kunnen afbreken?
- Wat zijn de purinebases in DNA?
- Studie onthult hoe cellen de groei van hun structurele filamenten organiseren
- Wat zijn de voordelen van prokaryoten?
- Van welke cellen delen dieren die plant niet hebben?
- Anisotropie van oppervlakteoxidevorming beïnvloedt de voorbijgaande activiteit van een oppervlaktereactie
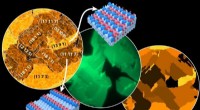
- Een organisch materiaal voor de volgende generatie HVAC-technologieën

- Levensrijk patroon:onderzoekers gebruiken geluid om de toekomst van printen vorm te geven

- Gefossiliseerde algen zijn veelbelovend voor verbeterde voedselveiligheidstesten
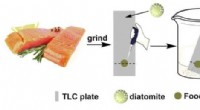
- Laboratoriumtechnologie biedt duidelijkheid te midden van zorgen over waterverontreiniging in Hawaï

 Kinderen lopen grootste risico op seksueel geweld in Kenia tijdens pandemie
Kinderen lopen grootste risico op seksueel geweld in Kenia tijdens pandemie Gedwongen verdwijningen nemen toe nu mensenrechtenschenders hun sporen uitwissen
Gedwongen verdwijningen nemen toe nu mensenrechtenschenders hun sporen uitwissen Nu Google 20 wordt, vragen of het te krachtig is?
Nu Google 20 wordt, vragen of het te krachtig is? Noord-Amerikaanse F-86 Sabre
Noord-Amerikaanse F-86 Sabre  Deken van rotspuin biedt gletsjers meer bescherming tegen klimaatverandering dan eerder bekend
Deken van rotspuin biedt gletsjers meer bescherming tegen klimaatverandering dan eerder bekend Dode vissen drijven Noorse cruiseschepen aan
Dode vissen drijven Noorse cruiseschepen aan Waarom is de vijver altijd koeler dan open veld?
Waarom is de vijver altijd koeler dan open veld?  Welk type kaart wordt waarschijnlijk gebruikt om de bevolkingsdichtheid van Grizzly Bear in Glacier National Park weer te geven?
Welk type kaart wordt waarschijnlijk gebruikt om de bevolkingsdichtheid van Grizzly Bear in Glacier National Park weer te geven?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

