
Wetenschap
KA voor acrylzuur is 0,000056 Bereken de pH van 0,10 m waterige oplossing Acidculate Percentage dissociatiezuur?
1. Zet een ijstafel op
Acrylzuur (ch₂ =chcooh) is een zwak zuur, dus het ioniseert slechts gedeeltelijk in water. We kunnen de ionisatie ervan weergeven met het volgende evenwicht:
Ch₂ =chcooh (aq) ⇌ h⁺ (aq) + ch₂ =chcoo⁻ (aq)
| | Ch₂ =chcooh | H⁺ | Ch₂ =chcoo⁻ |
| ------------- | -------------- | ------- | ------------- |
| Initiaal (i) | 0,10 m | 0 | 0 |
| Verander (c) | -x | +x | +x |
| Evenwicht (e) | 0.10 - x | X | X |
2. Schrijf de KA -expressie
Ka =[h⁺] [ch₂ =chcoo⁻] / [ch₂ =chcooh]
3. Vervangen en oplossen voor x
0.000056 =(x) (x) / (0.10 - x)
Omdat KA klein is, kunnen we aannemen dat X veel kleiner is dan 0,10, waardoor we de vergelijking kunnen vereenvoudigen:
0,000056 ≈ (x) (x) / 0,10
X² ≈ 0.0000056
x ≈ √0.0000056 ≈ 0,00237 m
4. Bereken de pH
pH =-log [h⁺] =-log (0.00237) ≈ 2.63
5. Bereken het percentage dissociatie
Dissociatie percentage =([H⁺] / [Initial Acid]) * 100%
Percentage dissociatie =(0,00237 / 0,10) * 100% ≈ 2,37%
Daarom:
* De pH van een waterige oplossing van 0,10 m van acrylzuur is ongeveer 2,63 .
* Het percentage dissociatie van acrylzuur in deze oplossing is ongeveer 2,37% .
 Wat is het doel van een trebuchet?
Wat is het doel van een trebuchet?  Bodems beschermen om klimaatverandering tegen te gaan
Bodems beschermen om klimaatverandering tegen te gaan Zaterdagcitaten:Tarantula's en hun homies; hoe muggen je vinden; zwarte gaten zijn helemaal niet mysterieus
Zaterdagcitaten:Tarantula's en hun homies; hoe muggen je vinden; zwarte gaten zijn helemaal niet mysterieus  Kun je me een wetenschappelijk onderwerp voor school geven?
Kun je me een wetenschappelijk onderwerp voor school geven?  Regeneratieve landbouw kan boeren weer rentmeesters van het land maken
Regeneratieve landbouw kan boeren weer rentmeesters van het land maken
Hoofdlijnen
- Nieuwe techniek verbetert proteoform-beeldvorming in menselijk weefsel
- Welk weefsel heeft een vloeistofmatrix zonder eiwitvezels?
- Landbouwproductiviteit dreef de Euro-Amerikaanse nederzetting van Utah
- Hoe moleculaire scharen ziekten kunnen oplossen en DNA kunnen bewerken
- Waarom groeien cellen op eiwitcoatedsteiger dan lege steiger?
- Houden drie maaltijden per dag schimmels weg?
- Wat zijn blaasjes parasieten?
- Hoe doden mensen bacteriën in hun lichaam?
- Hoe beïnvloeden Genotype en Fenotype hoe je eruit ziet?
- Australische onderzoekers vestigen record voor het afvangen van kooldioxide

- Ontdekking van geheel nieuwe klasse RNA-caps in bacteriën
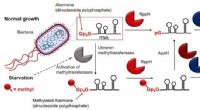
- Afvangen en omzetten van kooldioxide in een bruikbaar product

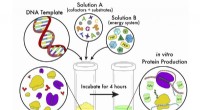
- Vereenvoudigde methode maakt celvrije eiwitsynthese flexibeler en toegankelijker
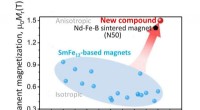
- Verbinding kan magnetisch beter presteren dan neodymiummagneten
 Terreur:de kracht van verhalen
Terreur:de kracht van verhalen Ionen die worden gebruikt om een rustpotentieel vast te stellen?
Ionen die worden gebruikt om een rustpotentieel vast te stellen?  Welke kernen zou het minst stabiel zijn?
Welke kernen zou het minst stabiel zijn?  Facebooks reality check zorgt ervoor dat de voorraad op hol slaat
Facebooks reality check zorgt ervoor dat de voorraad op hol slaat Welk aardsysteem omvat mensen?
Welk aardsysteem omvat mensen?  Hoe de vertex van een paraboolvergelijking te vinden
Hoe de vertex van een paraboolvergelijking te vinden Waar experimenteerde J. Thomson?
Waar experimenteerde J. Thomson?  Beelden van de zon van de GOES-16 satelliet
Beelden van de zon van de GOES-16 satelliet
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

