
Wetenschap
Wat is het verschil tussen gasvormige en vloeibare toestand van dezelfde stof?
Gaseous State:
* arrangement: Moleculen zijn ver uit elkaar en willekeurig verdeeld.
* Beweging: Moleculen bewegen vrij en snel in alle richtingen.
* krachten: Zwakke intermoleculaire krachten, waardoor moleculen onafhankelijk kunnen bewegen.
* Vorm en volume: Neemt de vorm en het volume van zijn container aan.
* Compressibiliteit: Zeer samendrukbaar vanwege grote ruimtes tussen moleculen.
* Dichtheid: Lage dichtheid als gevolg van brede afstand tussen moleculen.
vloeibare toestand:
* arrangement: Moleculen zijn dicht bij elkaar, maar kunnen langs elkaar bewegen.
* Beweging: Moleculen bewegen willekeurig maar met een langzamere snelheid dan gassen.
* krachten: Sterkere intermoleculaire krachten dan gassen, maar zwakker dan vaste stoffen.
* Vorm en volume: Neemt de vorm van zijn container aan, maar heeft een vast volume.
* Compressibiliteit: Minder samendrukbaar dan gassen als gevolg van nauwere verpakking.
* Dichtheid: Hogere dichtheid dan gassen als gevolg van nauwere verpakking.
Hier is een analogie:
* Stel je een groep mensen voor in een groot, open veld (gas). Ze kunnen vrij en onafhankelijk bewegen.
* Stel je nu dezelfde groep mensen voor in een drukke kamer (vloeistof). Ze zijn dichter bij elkaar en kunnen zich verplaatsen, maar met minder vrijheid.
Samenvattend:
Het belangrijkste verschil is de sterkte van intermoleculaire krachten :
* gassen: Zwakke krachten, moleculen bewegen vrijuit
* vloeistoffen: Sterkere krachten, moleculen bewegen minder vrij en handhaven een vast volume.
onthoud dat:
* Dit is een vereenvoudigde uitleg. Er zijn nuances en uitzonderingen.
* De toestand van een stof wordt bepaald door zijn temperatuur en druk.
* Sommige stoffen kunnen bestaan in alle drie staten van materie (vaste, vloeistof, gas), afhankelijk van de omstandigheden.
Hoofdlijnen
- Hoe zijn Dobzhansky en ideeën over de oorsprong van soorten vergelijkbaar met Darwins?
- Wat betekent BC en AC in de wetenschap?
- Wat is de naam van het ordelijke proces waarmee wetenschapper de natuur van geheimen onderzoeken?
- Welke is het dikste orgel in je lichaam?
- Interessante feiten over plantencellen
- Welke plant heeft geen stengel?
- Hoe beïnvloeden aanpassingen een soort?
- Is microtrabiculair rooster gevonden in dier- of plantencellen?
- Wat hebben menselijke cellen gemeen?
- Op textiel gebaseerde composieten kunnen de toekomst van lucht- en ruimtevaarttechniek weven

- Nucleatie een zegen voor duurzame nanofabricage

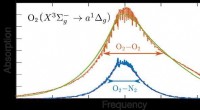
- Onderzoekers ontdekken hoe botsende zuurstofmoleculen licht absorberen
- Kleine elektrische velden kunnen een beslissende rol spelen bij de vorming van diamant

- De verrassende kracht van vloeibare kristallen
 Tevredenheid van medewerkers verbetert de financiële prestaties van het Britse bedrijf
Tevredenheid van medewerkers verbetert de financiële prestaties van het Britse bedrijf Natuurkundigen betreden nieuwe wegen, verken onbekende energiegebieden
Natuurkundigen betreden nieuwe wegen, verken onbekende energiegebieden Is het maken van zout water om te gorgelen voor een keelpijnchemische keel of fysieke verandering?
Is het maken van zout water om te gorgelen voor een keelpijnchemische keel of fysieke verandering?  Magnetische hyperthermie, een hulpmiddel bij kankerbehandelingen
Magnetische hyperthermie, een hulpmiddel bij kankerbehandelingen Voordeel en nadeel van elektromagnetische inductieverwarming?
Voordeel en nadeel van elektromagnetische inductieverwarming?  Wat is zachter marmeren of graniet?
Wat is zachter marmeren of graniet?  Wat is de laag van de aarde die het meeste volume bevat?
Wat is de laag van de aarde die het meeste volume bevat?  In welke vormen van energie is het snelheidslampje dat wordt gedragen?
In welke vormen van energie is het snelheidslampje dat wordt gedragen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


