
Wetenschap
Welke waarnemingen kunnen worden gedaan wanneer verdunde salpeterzuur wordt toegevoegd om carbonaat te leiden?
Observaties:
1. Fizzing/Effervescence: De meest directe observatie is de snelle vorming van bubbels, wat de afgifte van een gas aangeeft. Dit is koolstofdioxide (CO2), een product van de reactie.
2. ontbinding: Naarmate de reactie verloopt, zal het witte vaste loodcarbonaat (PBCO3) geleidelijk oplossen. Dit komt omdat het salpeterzuur reageert met het loodcarbonaat, waardoor oplosbaar loodnitraat wordt gevormd (PB (NO3) 2).
3. Kleurverandering: Aanvankelijk zal de oplossing kleurloos zijn. Naarmate de reactie vordert, kan een lichte gele tint verschijnen vanwege de vorming van loodionen in oplossing.
4. Temperatuurverandering: De reactie is enigszins exotherme, wat betekent dat het een kleine hoeveelheid warmte vrijgeeft. Misschien merk je een lichte opwarming van de oplossing.
chemische vergelijking:
De reactie kan worden weergegeven door de volgende evenwichtige chemische vergelijking:
PBCO3 (S) + 2 HNO3 (AQ) → PB (NO3) 2 (AQ) + H2O (L) + CO2 (G)
Verklaring:
* salpeterzuur (HNO3) is een sterk zuur, wat betekent dat het gemakkelijk waterstofionen (H+) schenkt.
* Loodcarbonaat (PBCO3) is een solide, onoplosbare verbinding.
* Lood nitraat (PB (NO3) 2) is een oplosbare ionische verbinding, dus het lost op in de oplossing.
* koolstofdioxide (CO2) is een kleurloos gas dat uit de oplossing ontsnapt, waardoor het bruisen.
* Water (H2O) wordt ook geproduceerd in de reactie.
Belangrijke opmerking:
* De concentratie van het salpeterzuur zal de reactiesnelheid beïnvloeden. Meer geconcentreerd zuur zal leiden tot een snellere reactie en meer krachtige bruisen.
* Lood -ionen zijn giftig, dus ga dit experiment met voorzichtigheid en gooi de oplossing goed weg.
 Vormt deuterium in D2O waterstofbruggen?
Vormt deuterium in D2O waterstofbruggen?  Is C6H14 een organische of anorganische verbinding?
Is C6H14 een organische of anorganische verbinding?  Welk type organische verbinding omvat altijd een carboxylgroep en een aminogroep?
Welk type organische verbinding omvat altijd een carboxylgroep en een aminogroep?  Nano3 Is het zure basic of neutraal wanneer opgelost in water?
Nano3 Is het zure basic of neutraal wanneer opgelost in water?  Wie is de Franse chemicus die die lucht een mengsel van gassen heeft ontdekt?
Wie is de Franse chemicus die die lucht een mengsel van gassen heeft ontdekt?
 Waarom fantastische sprookjesgemeenschappen net zo complex kunnen zijn als de onze
Waarom fantastische sprookjesgemeenschappen net zo complex kunnen zijn als de onze  VK, VS lanceren grootste studie ooit van Antarctische gletsjer
VK, VS lanceren grootste studie ooit van Antarctische gletsjer Definitie van goederen en diensten voor economie
Definitie van goederen en diensten voor economie Bodemverbeteringen voor gezondere spinazie
Bodemverbeteringen voor gezondere spinazie Proberen het hoofd boven water te houden:hoe het klimaatactieplan van Mumbai tekortschiet
Proberen het hoofd boven water te houden:hoe het klimaatactieplan van Mumbai tekortschiet
Hoofdlijnen
- Van stroper tot boswachter:de Siberische tijgers van China redden
- Hoe leidden de complementaire relaties tussen sequenties van nucleotiden tot DNA -replicatie van Discovery?
- Wat zijn de twee brede gebruiksgebieden en voorbeelden na een in kweek gekweekte gastheercel om klooncellen te vormen die gekloond genbelang bevatten?
- Hoe wordt het COX1 -eiwit nog steeds functionif -gen veranderd tussen soorten?
- Zijn er 3 manieren waarop schimmels zich voortplanten?
- Eerste onderzoek dat aantoont dat vogels en niet alleen zoogdieren geeuwen kopiëren
- Wat is endosmotische stroming bij elctroforese?
- Wat is een combinatie van twee genen samen genoemd?
- Rol van sucrose in DNA -isolatie uit menselijk bloed?
- Onderzoekers ontwikkelen biologisch afbreekbaar geprint display

- De microchipindustrie helpen (zeer laag) met de stroom mee te gaan

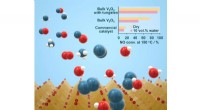
- Door wolfraam vervangen vanadiumoxide ademt frisse lucht in de katalysatortechnologie
- Team gebruikt heet water om fotokatalysator te vormen
- Afvalkoolstof van de staalproductie kan worden gerecycled tot nieuwe producten

 Koude lucht stijgt op – wat dat betekent voor het klimaat op aarde
Koude lucht stijgt op – wat dat betekent voor het klimaat op aarde  Wat beweegt het Golgi -apparaat in en uit de cel?
Wat beweegt het Golgi -apparaat in en uit de cel?  Wetenschappers ontwikkelen een geneesmiddel dat stuiptrekkingen stopt
Wetenschappers ontwikkelen een geneesmiddel dat stuiptrekkingen stopt Hoe beïnvloeden bomen het weer?
Hoe beïnvloeden bomen het weer?  Lanceringsdatum vastgesteld voor NASA's PREFIRE-missie om polair energieverlies te bestuderen
Lanceringsdatum vastgesteld voor NASA's PREFIRE-missie om polair energieverlies te bestuderen  Archeologen vinden Romeinse scheepswrakken voor de noordkust van Egypte
Archeologen vinden Romeinse scheepswrakken voor de noordkust van Egypte SpaceX details plannen om duizenden internetsatellieten te lanceren
SpaceX details plannen om duizenden internetsatellieten te lanceren Hoeveel graden Fahrenheit is 32 Celsius?
Hoeveel graden Fahrenheit is 32 Celsius?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

