
Wetenschap
Zou gebeuren als het evenwicht van een zwakke dissociatiereactie met zure dissociatie overstuur zou zijn?
LE Chatelier's principe:
Het principe van Le Chatelier stelt dat als een wijziging van de conditie wordt toegepast op een systeem in evenwicht, het systeem zal verschuiven in een richting die de stress verlicht. Dit geldt ook voor zwakke dissociatiereacties.
manieren om evenwicht te verstoren:
* meer zuur toevoegen: Dit verhoogt de concentratie van het niet -gedissocieerde zuur, waardoor het evenwicht naar rechts verschuift , voorstander van dissociatie om meer hydroniumionen (H₃o⁺) en de conjugaatbasis te produceren.
* Meer geconjugeerde basis toevoegen: Dit zal de concentratie van de conjugaatbasis verhogen, waardoor het evenwicht naar links verschuift , voor de voorkeur van de hervorming van het niet -gedisceerde zuur.
* Een sterk zuur toevoegen: Dit zal de concentratie van H₃o⁺ verhogen, waardoor het evenwicht naar links verschuift , voor de voorkeur van de hervorming van het niet -gedisceerde zuur. Dit komt omdat het sterke zuur de conjugaatbasis effectief verwijdert door neutralisatie.
* Een sterke basis toevoegen: Dit verwijdert H₃o⁺, waardoor het evenwicht naar rechts verschuift , voorstander van dissociatie ter vervanging van de verwijderde H₃o⁺.
* Een gemeenschappelijk ion toevoegen: Het toevoegen van een zout dat de conjugaatbasis van het zwakke zuur bevat, verhoogt de concentratie van dat ion, waardoor het evenwicht naar links verschuift , voor de voorkeur van de hervorming van het niet -gedisceerde zuur.
* de temperatuur wijzigen: Het verhogen van de temperatuur zal de voorkeur geven aan de endotherme reactie, die in dit geval de dissociatie van het zwakke zuur is. Het verlagen van de temperatuur zal de exotherme reactie bevorderen, wat de hervorming is van het niet -gedissocieerde zuur.
gevolgen van evenwichtsverschuiving:
* pH -verandering: Het verschuiven van het evenwicht zal de concentratie van H₃o⁺ veranderen, waardoor de pH van de oplossing direct wordt beïnvloed.
* Verhoogde of verminderde dissociatie: De mate van dissociatie van het zwakke zuur zal veranderen, wat leidt tot verschillende concentraties van het niet -gedissocieerde zuur en de conjugaatbasis ervan.
Voorbeeld:
Overweeg de dissociatie van azijnzuur (ch₃cooh):
Ch₃cooh (aq) + h₂o (l) ⇌ h₃o⁺ (aq) + ch₃coo⁻ (aq)
Het toevoegen van natriumacetaat (ch₃coona) aan deze oplossing zou de concentratie van de conjugaatbasis verhogen (ch₃coo⁻). Dit zou het evenwicht naar links verschuiven, waardoor de dissociatie van azijnzuur wordt verminderd en leidt tot een hogere pH (minder zure) oplossing.
Samenvattend, het inzicht in het principe van Le Chatelier stelt u in staat te voorspellen hoe het evenwicht van een zwakke zuurdissociatiereactie zal worden beïnvloed door verschillende veranderingen in omstandigheden.
 Hoe het in kaart brengen van de Galápagos duurzamere steden kan creëren
Hoe het in kaart brengen van de Galápagos duurzamere steden kan creëren Hawaïaanstalige kranten belichten een orkaan uit 1871
Hawaïaanstalige kranten belichten een orkaan uit 1871 Kijk naar de planten voor vroegtijdige droogtewaarschuwingen
Kijk naar de planten voor vroegtijdige droogtewaarschuwingen Grote aardbeving treft Noord-Japan, 9 doden achterlatend, 30 vermist
Grote aardbeving treft Noord-Japan, 9 doden achterlatend, 30 vermist Ontbrekende schakel in algenfotosynthese gevonden, biedt de mogelijkheid om de gewasopbrengst te verbeteren
Ontbrekende schakel in algenfotosynthese gevonden, biedt de mogelijkheid om de gewasopbrengst te verbeteren
Hoofdlijnen
- Great Salt Lake op weg naar hyperzoutgehalte, spiegelend Iraans meer, blijkt uit nieuw onderzoek
- Zijn leefgebied is gedecimeerd, deze charismatische vogel uit Minnesota danst op de rand van de vergetelheid
- Onderzoeksthema's in de biotechnologie
- Nieuwe studie laat zien hoe vogels samenwerken om samen te zingen
- Wat zijn de protozoa die niet in staat is tot onafhankelijke beweging?
- Hoe zijn lypids en eiwitten vergelijkbaar?
- Welke twee koninkrijken bevatten alleen micro -organismen?
- Kunnen dierencellen hun eigen cellen maken?
- Waarom is DNA belangrijk en waaruit het bestaat?
- Fluor stroomt naar binnen, maakt materiaal metaal
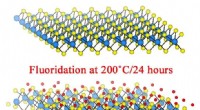
- Team ontwikkelt machine met als doel een einde te maken aan textielverspilling

- Biochar kan koolstofopslag stimuleren, maar voordelen voor kieming en groei lijken schaars

- Schoonmaakster maken, groener, milieuvriendelijke zonnebrandcrème

- Machine learning voorspelt mechanische eigenschappen van poreuze materialen
 Math Games van het eerste, tweede en derde leerjaar
Math Games van het eerste, tweede en derde leerjaar Hoe wordt de wetenschap gebruikt in paleontologie?
Hoe wordt de wetenschap gebruikt in paleontologie?  Waarom is je tempurpedic zo hard als steen?
Waarom is je tempurpedic zo hard als steen?  Nieuw metasurface-gebaseerd apparaat maakt verschillende afbeeldingen afhankelijk van licht en omgevingsomstandigheden
Nieuw metasurface-gebaseerd apparaat maakt verschillende afbeeldingen afhankelijk van licht en omgevingsomstandigheden Hoe een bacterie de plasticvervuilingscrisis kan helpen oplossen
Hoe een bacterie de plasticvervuilingscrisis kan helpen oplossen  Wat is de afstand van Sirius tot aarde?
Wat is de afstand van Sirius tot aarde?  Optische frequentiekammen met een nieuwe dimensie
Optische frequentiekammen met een nieuwe dimensie Energiestroom in grote moleculen volgen
Energiestroom in grote moleculen volgen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

