
Wetenschap
Omdat de elektronen in een molecuul waterstoffluoride (HF) sterker worden getrokken naar fluoratoom is niet -polair.
* elektronegativiteit: Fluor (F) is veel elektronegatiefer dan waterstof (H). Dit betekent dat fluor een sterkere aantrekking heeft voor gedeelde elektronen in een binding.
* Polaire covalente binding: Het verschil in elektronegativiteit tussen fluor en waterstof creëert een polaire covalente binding. Dit betekent dat de elektronen niet gelijk worden gedeeld, wat resulteert in een gedeeltelijke negatieve lading (Δ-) op het fluoratoom en een gedeeltelijke positieve lading (Δ+) op het waterstofatoom.
* Moleculair dipoolmoment: Vanwege de ongelijke verdeling van de lading heeft het HF -molecuul een netto dipoolmoment. Dit dipoolmoment maakt het molecuul polair.
Samenvattend: Het ongelijke delen van elektronen vanwege het verschil in elektronegativiteit tussen waterstof en fluor leidt tot een polair molecuul met een dipoolmoment.
Hoofdlijnen
- Wat is het belang van microscoop in zolaogie?
- In het Ecuadoraanse Amazonegebied vormen vlinders een graadmeter voor de klimaatverandering
- Hoe wordt een wetenschappelijke hypothese geëvalueerd?
- Beren hebben geen last van een dieet met veel verzadigde vetten
- Geen microben? probleem voor rupsen
- Hoe is DNA vergelijkbaar met Morse -code?
- Hoe kunnen twee planten met een ander genotype hetzelfde fenotype hebben?
- Waarom zijn kalkoenen genetisch gemodificeerd?
- Eerste video's die de helix van 'dansend DNA' laten zien, ontwikkeld door wetenschappers
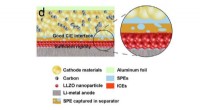
- Onderzoekers ontwerpen dendrietvrije lithiumbatterij
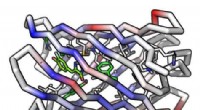
- Fluorescentie-activerend bèta-vat-eiwit voor het eerst helemaal opnieuw gemaakt
- Een nieuwe methode om de efficiëntie van kristalhalfgeleiders te kwantificeren

- Machine learning-model voorspelt fenomeen dat essentieel is voor het begrijpen van materiaaleigenschappen

- Onderzoekers ontwikkelen taaie, zelfherstellend rubber

 Bandieten verliezen hun interesse in het beroven van banken, omdat sommige misdaden niet langer lonen
Bandieten verliezen hun interesse in het beroven van banken, omdat sommige misdaden niet langer lonen  Is multi -doelklevend hetzelfde als siliconen?
Is multi -doelklevend hetzelfde als siliconen?  Scandinaviërs kleine taalkundige hattrick
Scandinaviërs kleine taalkundige hattrick Wanneer substantie veranderingen vormt, wat gebeurt er met de dichtheid?
Wanneer substantie veranderingen vormt, wat gebeurt er met de dichtheid?  Hoe noem je een nummer met 22 nullen?
Hoe noem je een nummer met 22 nullen?  Eerste onderzoek naar terahertz-straling in vloeistoffen
Eerste onderzoek naar terahertz-straling in vloeistoffen Hoe 'plakkerig' is dichte nucleaire materie?
Hoe 'plakkerig' is dichte nucleaire materie?  Voorspelling orkaan in de Stille Oceaan gecompliceerd door coronavirus
Voorspelling orkaan in de Stille Oceaan gecompliceerd door coronavirus
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


