
Wetenschap
Wat was er mis met de structuur van Niels Bohr Atom?
1. Elektronenorbitalen:
* Bohr's model: Stelde voor dat elektronen rond de kern draaien in vaste, cirkelvormige paden die banen worden genoemd, vergelijkbaar met planeten die rond de zon draaien.
* realiteit: Kwantummechanica toonde aan dat elektronen niet om een baan om in vaste paden. In plaats daarvan bezetten ze orbitalen , die driedimensionale ruimte zijn van ruimte waar de kans op het vinden van een elektron hoog is. Deze orbitalen zijn geen eenvoudige cirkelvormige paden, maar eerder complexe vormen.
2. Elektronenergieniveaus:
* Bohr's model: Legde uit dat elektronen alleen in specifieke energieniveaus konden bestaan en ertussen zouden springen door fotonen te absorberen of uit te zenden.
* realiteit: Hoewel het concept van gekwantiseerde energieniveaus correct was, vereenvoudigde het model de realiteit. Kwantummechanica toonde aan dat elektronen niet onmiddellijk tussen niveaus springen, maar eerder overgangen ondergaan Dat kan tussenliggende energietoestanden met zich meebrengen.
3. Spectrale lijnen:
* Bohr's model: Met succes het emissiespectrum van waterstof uitgelegd en de waargenomen lijnen voorspellen.
* realiteit: Het slaagde er niet in om de spectrale lijnen van atomen met meerdere elektronen nauwkeurig te voorspellen. Kwantummechanica zorgde voor een completere verklaring voor de complexiteit van spectrale lijnen.
4. Elektronenspin:
* Bohr's model: Gemaakte geen rekening met het intrinsieke hoekmomentum van elektronen, bekend als spin.
* realiteit: Elektronenspin is een fundamentele eigenschap van elektronen en speelt een cruciale rol in de atomaire structuur en chemische binding.
5. Atomische structuur:
* Bohr's model: Stelde een eenvoudige, planetaire structuur voor met elektronen die rond de kern draaien.
* realiteit: Kwantummechanica toonde aan dat de kern is omgeven door een wolk van elektronen die orbitalen bezetten, geen vaste banen. Dit leidde tot de ontwikkeling van meer geavanceerde modellen van atomaire structuur.
Over het algemeen:
Hoewel het model van Niels Bohr een belangrijke vooruitgang was, was het een vereenvoudigd beeld van het atoom. Kwantummechanica zorgde voor een veel nauwkeuriger en complexer begrip van het gedrag van elektronen en de structuur van atomen. Het model van Bohr blijft echter een waardevol hulpmiddel voor het begrijpen van basisconcepten van atomaire structuur.
 Wat is de VSEPR van CCL4?
Wat is de VSEPR van CCL4?  Onderzoekers herontdekken snelwerkend Duits insecticide dat verloren was gegaan in de nasleep van de Tweede Wereldoorlog
Onderzoekers herontdekken snelwerkend Duits insecticide dat verloren was gegaan in de nasleep van de Tweede Wereldoorlog Op de natuur geïnspireerd materiaal maakt gebruik van vloeibare versterking
Op de natuur geïnspireerd materiaal maakt gebruik van vloeibare versterking Wat is de definitie voor verandering en wetenschappelijke termen?
Wat is de definitie voor verandering en wetenschappelijke termen?  Waarom worden materialen met een hoge en lage pH als gevaarlijk beschouwd?
Waarom worden materialen met een hoge en lage pH als gevaarlijk beschouwd?
 Luchtvervuiling in verband met gemiste miskramen in China:studie
Luchtvervuiling in verband met gemiste miskramen in China:studie Wetenschappers combineren Twitter- en satellietbeelden om de epische impact te begrijpen
Wetenschappers combineren Twitter- en satellietbeelden om de epische impact te begrijpen Sri Lanka vindt zwarte doos van zinkend schip
Sri Lanka vindt zwarte doos van zinkend schip Klimaatverandering om economieën van rijke, arm, zowel warme als koude landen, tenzij de Overeenkomst van Parijs geldt
Klimaatverandering om economieën van rijke, arm, zowel warme als koude landen, tenzij de Overeenkomst van Parijs geldt Computermodellen suggereren dat de moderne platentektoniek het gevolg is van klodders die zijn achtergelaten door kosmische botsingen
Computermodellen suggereren dat de moderne platentektoniek het gevolg is van klodders die zijn achtergelaten door kosmische botsingen
Hoofdlijnen
- Hoe intracellulaire vloeistofstromen de vorming van complexe patronen beïnvloeden
- Wat is de naam voor het lichaam van kennis verkregen door methoden op basis van systematische observatie?
- Gesynchroniseerd:hoe cellen verbindingen maken, kan van invloed zijn op het circadiane ritme
- Geef twee voorbeelden van hoe mensen water gebruiken op een manier waarop andere organismen dat niet doen?
- Kan boos worden goed voor je zijn?
- Hoe werken abiotische en biotische factoren samen in het ecosysteem?
- Wat is Ester van Wood Rosen?
- 3D-geprint voedsel kan de manier waarop we eten veranderen
- Wat zijn de vier hoofdfuncties van het skeletstelsel?
- Nieuwe interactie tussen dunne-filmmagneten voor snellere geheugenapparaten

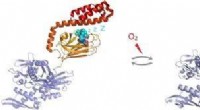
- S-glutathionylering van door mensen induceerbaar Hsp70 onthult een regulerend mechanisme met betrekking tot het C-terminale α-helix deksel
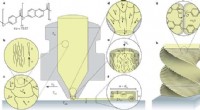
- 3D-printen van hiërarchische structuren van vloeibaar kristal-polymeer
- Grote druppelsortering nu mogelijk bij hoge snelheden

- Ingenieurs maken de basisbouwsteen voor elektrospun nanovezels
 Is koper-II-bromide covalent of ionisch?
Is koper-II-bromide covalent of ionisch?  Hoogwaardig SERS-substraat voorgesteld op basis van 2H-TaS2 en goudclusters met één atoomlaag
Hoogwaardig SERS-substraat voorgesteld op basis van 2H-TaS2 en goudclusters met één atoomlaag  Methaan op Mars:een nieuwe ontdekking of gewoon veel hete lucht?
Methaan op Mars:een nieuwe ontdekking of gewoon veel hete lucht? Studie verklaart waarom sterrenstelsels stoppen met het maken van sterren
Studie verklaart waarom sterrenstelsels stoppen met het maken van sterren  Welke andere gegevens naast fysieke kenmerken gebruiken wetenschappers om te vinden of organismen gerelateerd zijn?
Welke andere gegevens naast fysieke kenmerken gebruiken wetenschappers om te vinden of organismen gerelateerd zijn?  Hoe verklaart u het belang van standaardeenheden?
Hoe verklaart u het belang van standaardeenheden?  Op welke deeltjes werken de sterke en zwakke nucleaire krachten?
Op welke deeltjes werken de sterke en zwakke nucleaire krachten?  Nee, we hebben geen nieuwe ideeën meer
Nee, we hebben geen nieuwe ideeën meer
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

