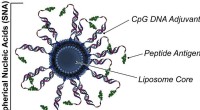
Wetenschap
Zal de pH van een bufferoplossing hoger of lager zijn dan zwak zuur?
* Zwak zuur alleen: Een zwak zuur zal gedeeltelijk ionen in water, waardoor sommige waterstofionen (H+) worden vrijgeeft. Dit resulteert in een enigszins zure pH.
* bufferoplossing: Een bufferoplossing bestaat uit een zwak zuur en de conjugaatbasis. De conjugaatbasis kan waterstofionen accepteren, effectief "opzuigen" en voorkomen dat de oplossing te zuur wordt. Dit resulteert in een hogere pH in vergelijking met alleen het zwakke zuur.
Denk er op deze manier aan: De geconjugeerde basis werkt als een "spons" voor waterstofionen, waardoor de oplossing minder zuur is (hogere pH).
Voorbeeld:
* Azijnzuur (CH3COOH) is een zwak zuur. De pH zal enigszins zuur zijn.
* Een bufferoplossing van azijnzuur en natriumacetaat (CH3Coona) zal een hogere pH hebben dan alleen azijnzuur omdat de acetaationen (CH3COO-) kunnen reageren met overtollige waterstofionen, waardoor de pH stabieler blijft.
 Onderzoekers ontdekken hoe ze kunnen voorkomen dat formaldehyde waterstofproducerende enzymen remt
Onderzoekers ontdekken hoe ze kunnen voorkomen dat formaldehyde waterstofproducerende enzymen remt  Is polyvinylchloride giftig bij aanraking?
Is polyvinylchloride giftig bij aanraking?  Nieuwe functie voor plantenenzym kan leiden tot groene chemie
Nieuwe functie voor plantenenzym kan leiden tot groene chemie Wat zijn de chemicaliën die deel uitmaken van zaagsel?
Wat zijn de chemicaliën die deel uitmaken van zaagsel?  Gebruikt fotosynthese kooldioxide en water als reactant?
Gebruikt fotosynthese kooldioxide en water als reactant?
Hoofdlijnen
- Japanse dierentuin rouwt om dood van verliefde pinguïn
- Luie mieren maken zichzelf op onverwachte manieren nuttig
- Hoe 2 ... Bepaal wat Google over u zegt
- Hoeveel splitsing heeft Biotite?
- Wat houdt DNA in de kern die wordt omsloten door zijn eigen membraan?
- Wat zijn de bouwstenen van dit biomolecuul Amylase?
- Groene Brexit laten werken voor landbouw en milieu
- Wat zijn de kenmerken van de wetenschappelijke methode?
- Gymnospermen: definitie, levenscyclus, typen en voorbeelden
 Alvorens de weg op te gaan, zelfrijdende auto's moeten een rijexamen afleggen
Alvorens de weg op te gaan, zelfrijdende auto's moeten een rijexamen afleggen Hoe de Pilbara meer dan 3 miljard jaar geleden werd gevormd
Hoe de Pilbara meer dan 3 miljard jaar geleden werd gevormd Kleimineraalwateren De aarde mantelt van binnenuit
Kleimineraalwateren De aarde mantelt van binnenuit Hoeveel ml in 395 g?
Hoeveel ml in 395 g?  Trump gooit Obama's schone energieplan weg omarmt steenkool
Trump gooit Obama's schone energieplan weg omarmt steenkool Hoe groeit planten in scheuren biologische verwering?
Hoe groeit planten in scheuren biologische verwering?  Heeft het verbranden van fossiele brandstoffen invloed op de watercyclus?
Heeft het verbranden van fossiele brandstoffen invloed op de watercyclus?  Welke geologische kenmerken worden veroorzaakt door een subductie?
Welke geologische kenmerken worden veroorzaakt door een subductie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com