
Wetenschap
Wat is de verbinding die is geclassificeerd als een zout?
Hier is een uitsplitsing:
* zuur: Een stof die waterstofionen (H+) schenkt wanneer opgelost in water. Voorbeelden zijn zoutzuur (HCL) en zwavelzuur (H₂SO₄).
* basis: Een stof die waterstofionen (H+) accepteert wanneer opgelost in water. Voorbeelden zijn natriumhydroxide (NaOH) en kaliumhydroxide (KOH).
Wanneer een zuur en een basis reageren, neutraliseren ze elkaar, vormen ze water (h₂o) en een zout.
Voorbeelden van zouten:
* Natriumchloride (NaCl): Gevormd uit de reactie van zoutzuur (HCL) en natriumhydroxide (NaOH).
* kaliumsulfaat (k₂so₄): Gevormd uit de reactie van zwavelzuur (h₂so₄) en kaliumhydroxide (KOH).
* calciumcarbonaat (caco₃): Gevormd uit de reactie van carbonzuur (H₂co₃) en calciumhydroxide (Ca (OH) ₂).
Key -kenmerken van zouten:
* Het zijn meestal ionische verbindingen, wat betekent dat ze bestaan uit positief geladen ionen (kationen) en negatief geladen ionen (anionen).
* Ze zijn meestal kristallijne vaste stoffen bij kamertemperatuur.
* Ze kunnen oplossen in water en vormen oplossingen die elektriciteit leiden.
Opmerking: Er zijn ook enkele uitzonderingen op deze definitie, zoals organische zouten die mogelijk geen traditionele zuur-base-reactie inhouden.
 Is het een vaste vloeistof of gas van een personen?
Is het een vaste vloeistof of gas van een personen?  Hoeveel equivalenten Mg^ 2+ zijn er aanwezig in een oplossing die 2,60 mol 2 bevat?
Hoeveel equivalenten Mg^ 2+ zijn er aanwezig in een oplossing die 2,60 mol 2 bevat?  Onderzoek naar perovskiet-silicium tandemcellen laat nieuwe weg zien
Onderzoek naar perovskiet-silicium tandemcellen laat nieuwe weg zien Baking Powder Science Projects
Baking Powder Science Projects Preprints:hoe concept-academische papers essentieel zijn geworden in de strijd tegen COVID
Preprints:hoe concept-academische papers essentieel zijn geworden in de strijd tegen COVID
 Wat is de symbiotische relatie tussen maretak en sparren planten?
Wat is de symbiotische relatie tussen maretak en sparren planten?  Antarctische lava levert aanwijzingen voor het magnetische veld van de aarde in het verleden
Antarctische lava levert aanwijzingen voor het magnetische veld van de aarde in het verleden Supervulkanen:een sleutel tot de elektrische toekomst van Amerika?
Supervulkanen:een sleutel tot de elektrische toekomst van Amerika? Hoe stadstuinen goed zijn voor ecosystemen en mensen
Hoe stadstuinen goed zijn voor ecosystemen en mensen  Wolken en roet:luchtvervuiling en interacties tussen de atmosfeer begrijpen
Wolken en roet:luchtvervuiling en interacties tussen de atmosfeer begrijpen
Hoofdlijnen
- Leuke organismen eindigen als eerste:waarom samenwerkers op de lange termijn altijd winnen
- Wat is het effect van natrium op de kieming van planten?
- Onderzoek laat zien hoe honingbijen dode partners herkennen
- De ziekte van Tay-Sachs is een menselijke genetische abnormaliteit die resulteert in cellen die zich ophopen en verstopt raken met zeer grote complexe lipiden welke cellulaire organel deze aandoening moet zijn?
- Welke organel in een autotrofe eukaryotische cel gevonden?
- Opkomende infectieziekte bedreigt Darwins kikker met uitsterven
- Hoeveel nucleotiden zitten er in één triplet?
- Onderzoekers ontdekken hoe fruitvliegjes leren om reeds bevruchte vrouwtjes te omzeilen
- Wat is het verschil tussen erfelijke en milieudefecten?
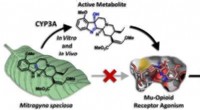
- Kratoms befaamde pijnstillende voordelen kunnen afkomstig zijn van een van zijn metabolieten
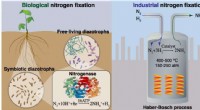
- Groenere benaderingen van stikstofbinding verkennen
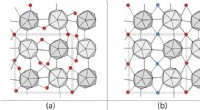
- Een nieuw recept voor het efficiënt verwijderen van intrinsieke defecten uit harde kristallen
- De DNA-smeltcurve nauwkeuriger maken

- Bio-sensing contactlens kan op een dag bloedglucose meten, andere lichaamsfuncties

 Verontruste Alitalia zegt drie overnamebiedingen te krijgen
Verontruste Alitalia zegt drie overnamebiedingen te krijgen Modulerende foto- en elektroluminescentie in een op stimuli reagerende moleculaire kleurstof
Modulerende foto- en elektroluminescentie in een op stimuli reagerende moleculaire kleurstof Wanneer werd de Big Dipper -constellatie ontdekt?
Wanneer werd de Big Dipper -constellatie ontdekt?  Studie:Netwerkmodel voor impliciete metingen van attitudes
Studie:Netwerkmodel voor impliciete metingen van attitudes Hoe u uw goede doel kunt promoten op Twitter en Facebook (zonder vervelend te zijn)
Hoe u uw goede doel kunt promoten op Twitter en Facebook (zonder vervelend te zijn)  Wat is het derde kwantumnummer voor een van de elektronen in de broom op het energieniveau?
Wat is het derde kwantumnummer voor een van de elektronen in de broom op het energieniveau?  Waarom zou je vergelijkbare rotsen of rotsstructuren verwachten in twee landmassa's die ooit met elkaar verbonden waren?
Waarom zou je vergelijkbare rotsen of rotsstructuren verwachten in twee landmassa's die ooit met elkaar verbonden waren?  Marsrover komt leeg in 1e poging om rockmonster te krijgen
Marsrover komt leeg in 1e poging om rockmonster te krijgen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

