
Wetenschap
Geeft een niet -metaal elektronen weg in chemische reactie?
* elektronegativiteit: Niet -metalen hebben een hogere elektronegativiteit dan metalen. Elektronegativiteit is het vermogen van een atoom om elektronen naar zichzelf aan te trekken.
* valentie -elektronen: Niet -metalen hebben meestal bijna volledige buitenste elektronenschalen. Ze willen een stabiele configuratie bereiken met acht elektronen in hun buitenste schaal (octetregel). Het verkrijgen van elektronen helpt hen dit te bereiken.
* Vorming van anionen: Wanneer niet -metalen elektronen krijgen, vormen ze negatief geladen ionen die anionen worden genoemd.
Voorbeeld:
Beschouw de reactie tussen natrium (een metaal) en chloor (een niet -metaal) om natriumchloride (NaCl) te vormen:
* Natrium (NA) heeft één elektron in de buitenste schaal en heeft de neiging om het te verliezen om een positief geladen ion te worden (Na+).
* Chloor (CL) heeft zeven elektronen in de buitenste schaal en heeft de neiging om één elektron te krijgen om een negatief geladen ion te worden (Cl-).
In deze reactie krijgt het niet -metalen chloor een elektron van het metalen natrium, waardoor een ionische binding tussen hen wordt gevormd.
Uitzonderingen:
Hoewel niet -metalen meestal elektronen krijgen, zijn er enkele uitzonderingen. In sommige reacties kunnen niet -metalen bijvoorbeeld elektronen delen met andere niet -metalen, waardoor covalente bindingen worden gevormd.
 Wat is de chloralkali -industrie?
Wat is de chloralkali -industrie?  Wat is de chemische formule van gemodificeerd voedselzetmeel?
Wat is de chemische formule van gemodificeerd voedselzetmeel?  Team rapporteert diamanten ringarchitectuur van een eiwitcomplex
Team rapporteert diamanten ringarchitectuur van een eiwitcomplex Wat is de uitgebalanceerde chemische vergelijking voor de ontleding van kalksteen tot calciumoxide en kooldioxide?
Wat is de uitgebalanceerde chemische vergelijking voor de ontleding van kalksteen tot calciumoxide en kooldioxide?  Welk type materiaal vormen atomen als ze dicht bij elkaar zijn en lage energie hebben?
Welk type materiaal vormen atomen als ze dicht bij elkaar zijn en lage energie hebben?
 Europese insecten verspreidden zich over de hele wereld. Was het omdat kolonisten planten droegen?
Europese insecten verspreidden zich over de hele wereld. Was het omdat kolonisten planten droegen?  Wat als muggen uitgestorven zijn?
Wat als muggen uitgestorven zijn?  Chemische voetafdruk in de huidige atmosfeer bootst die waargenomen in oud gesteente na
Chemische voetafdruk in de huidige atmosfeer bootst die waargenomen in oud gesteente na Bodem is de sleutel tot de geschiedenis (en toekomst) van de aarde
Bodem is de sleutel tot de geschiedenis (en toekomst) van de aarde Mushroom Hunting in North Idaho
Mushroom Hunting in North Idaho
Hoofdlijnen
- Wat is de wetenschappelijke naam van afval?
- Wat is een fossiel?
- Dragen axonen actiepotentialen weg van het cellichaam?
- Uitbreiding tonijnquota stap achteruit voor instandhouding
- Wat zijn de drie soorten koolhydraten en wat gebruikt er?
- In welk proces worden fossielen gevormd door de compressie van dode organismen in de loop van de tijd?
- Wat maakt een uitleg goed genoeg?
- Waarom gebruiken wetenschappers tweelingen om te leren over menselijke kenmerken?
- Waar is exedrine van gemaakt?
- Op weg naar de ontwikkeling van medicijnen voor aan veroudering gerelateerde ziekten
- Nieuwe katalysator helpt koolstofdioxide om te zetten in brandstof

- Kristallen die aardgas zuiveren

- Wetenschappers bootsen neuraal weefsel na

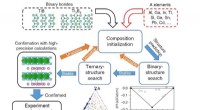
- Een speld in een hooiberg vinden:ontdekking van Ti2InB2 voor het synthetiseren van gelaagde TiB
 Hoe ver door zijn levenscyclus is de zon?
Hoe ver door zijn levenscyclus is de zon?  Neonicotinoïden gedetecteerd in drinkwater in landbouwgebied
Neonicotinoïden gedetecteerd in drinkwater in landbouwgebied Is een voorbeeld van pure chemie?
Is een voorbeeld van pure chemie?  Innovatie vergroot het waarneembare volume van het heelal met een factor zeven
Innovatie vergroot het waarneembare volume van het heelal met een factor zeven Wildfire-experts geven advies voor nieuwe onderzoeksrichtingen
Wildfire-experts geven advies voor nieuwe onderzoeksrichtingen Wat is de vereiste dat een molecuul UV actief is?
Wat is de vereiste dat een molecuul UV actief is?  Hoe bespaart een katrol energie?
Hoe bespaart een katrol energie?  Wat zijn nadelen van mechanische energie dagelijks in het leven?
Wat zijn nadelen van mechanische energie dagelijks in het leven?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

