
Wetenschap
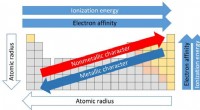
Waarom is het moeilijk om elektronenaffiniteiten voor metalen te bepalen?
* metalen verliezen de neiging elektronen te verliezen, niet te winnen: Elektronenaffiniteit is de energieverandering die optreedt wanneer een elektron wordt toegevoegd aan een neutraal atoom in de gasvormige toestand. Metalen hebben lage ionisatie -energieën, wat betekent dat ze gemakkelijk elektronen verliezen om positieve ionen (kationen) te vormen. Hierdoor worden ze minder kans om een elektron te krijgen en een negatief ion (anion) te vormen.
* De toevoeging van een elektron aan een metaalatoom is vaak energetisch ongunstig: Wanneer een metaalatoom een elektron krijgt, ervaart het toegevoegde elektron afstoting van de bestaande elektronen. Deze afstoting maakt het proces energetisch ongunstig en daarom is de elektronenaffiniteitswaarde vaak negatief of erg klein.
* Experimentele moeilijkheden: Het meten van elektronenaffiniteit voor metalen is een uitdaging. Het proces is vaak te complex en vereist gespecialiseerde technieken die niet altijd beschikbaar zijn.
daarentegen hebben niet -metalen over het algemeen een veel sterkere neiging om elektronen te winnen. Dit komt omdat hun elektronenconfiguraties dicht bij een stabiele edelgasconfiguratie liggen en het toevoegen van een elektron hun buitenste schaal vult. Dit maakt het elektronenproces energetisch gunstig, resulterend in positieve en gemakkelijk meetbare elektronenaffiniteitswaarden.
Hoewel het een uitdaging is om direct elektronenaffiniteiten voor metalen te meten, kunnen theoretische berekeningen worden gebruikt om deze waarden te schatten. Deze berekeningen hebben echter vaak beperkingen en weerspiegelen mogelijk niet nauwkeurig de experimentele realiteit.
 Wanneer is het watermolecuul tijdens de lichte reactie split?
Wanneer is het watermolecuul tijdens de lichte reactie split?  Wat zijn de elementen van suiker en C12H22O11?
Wat zijn de elementen van suiker en C12H22O11?  Een chemisch criterium voor het beoordelen van films
Een chemisch criterium voor het beoordelen van films Wat is de meest waarschijnlijke elektronenconfiguratie voor een natriumion in zijn grondtoestand?
Wat is de meest waarschijnlijke elektronenconfiguratie voor een natriumion in zijn grondtoestand?  Polyethyleenproductieproces met hoge dichtheid
Polyethyleenproductieproces met hoge dichtheid
 Wat is het verschil tussen een boom en kruidachtige plant?
Wat is het verschil tussen een boom en kruidachtige plant?  Algen bloeien irk Canarische strandgangers
Algen bloeien irk Canarische strandgangers Klimaatwetenschappers bereiken ondubbelzinnige consensus over door de mens veroorzaakte opwarming in historisch rapport
Klimaatwetenschappers bereiken ondubbelzinnige consensus over door de mens veroorzaakte opwarming in historisch rapport Hoe noem je de tak van de wetenschap die zich bezighoudt met relatie man en andere levende wezens tot hun omgeving?
Hoe noem je de tak van de wetenschap die zich bezighoudt met relatie man en andere levende wezens tot hun omgeving?  Veelbelovende mobiele technologieën vinden snel methaanlekken, studie vondsten
Veelbelovende mobiele technologieën vinden snel methaanlekken, studie vondsten
Hoofdlijnen
- Welk deel van een nucleïnezuur maakt het mogelijk om vormcode (2 punt) te worden gebruikt?
- Wat zijn vier primaire bacteriële vormen?
- Wat betekent dat huidstamcellen alleen andere cellen kunnen produceren?
- Waarom evolueer het organisme in de loop van de tijd?
- Hoe de gedachten van een kwal te lezen
- Uit onderzoek blijkt dat de mitochondriale fosfaatdrager een belangrijke rol speelt bij de virulentie van Candida albicans
- Seks en de symbiont:kunnen algenaansluitingen koralen helpen overleven?
- Hoe bacteriën hun onzichtbaarheidsmantels hechten aan de immuunafweer
- Hoe hersenspoeling werkt
- Het periodiek systeem begrijpen door de lens van de vluchtige Groep I metalen
- Onderzoekers ontwikkelen nieuwe bijna-ultraviolette LED-prikkelbare nabij-infraroodstralers
- Sneller giftige kankerverwekkende metalen vinden in voedsel en water

- Voordeel:Water—Onderzoekers lossen belangrijke vraag op over titaniumoxide, water interacties

- Mechanisme van remming van schorpioentoxine van K+-kanaal opgehelderd met behulp van snelle AFM
 Een vrachtwagen reist van en naar een steengroeve die 2,5 km het oosten bevindt, wat zijn totale afstand?
Een vrachtwagen reist van en naar een steengroeve die 2,5 km het oosten bevindt, wat zijn totale afstand?  Wat is het verschil tussen aluminiumsulfide en sulfaat?
Wat is het verschil tussen aluminiumsulfide en sulfaat?  Onderzoekers ontdekken de rol van aardbevingsbewegingen bij het veroorzaken van een verrassende tsunami
Onderzoekers ontdekken de rol van aardbevingsbewegingen bij het veroorzaken van een verrassende tsunami Kenmerken van een bergecosysteem
Kenmerken van een bergecosysteem Waar kun je paleontologie studeren?
Waar kun je paleontologie studeren?  Waarom ziet de maan er zoveel groter uit als hij dichtbij de horizon staat?
Waarom ziet de maan er zoveel groter uit als hij dichtbij de horizon staat?  Buurtwacht:wat de missie om de Melkweg in kaart te brengen onthult over satellietstelsels
Buurtwacht:wat de missie om de Melkweg in kaart te brengen onthult over satellietstelsels Het verband tussen negatieve stijfheid en magnetische domeinwanden blootleggen
Het verband tussen negatieve stijfheid en magnetische domeinwanden blootleggen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

