
Wetenschap
Hoe kan de massa van een atoom van periodiek worden weergegeven met betrekking tot mol?
Hier is hoe het werkt:
* Atomische massa: Het periodiek systeem geeft een overzicht van de atomaire massa van elk element. Deze massa wordt uitgedrukt in atomaire massa -eenheden (AMU) .
* Molaire massa: Eén mol van elk element bevat Avogadro's nummer (6.022 x 10^23) atomen. De molaire massa is de massa van één mol van dat element. Het is numeriek gelijk aan de atoommassa, maar de eenheden zijn gram per mol (g/mol) .
Voorbeeld:
* koolstof (c): De atoommassa van koolstof is 12.01 AMU. Dit betekent dat één koolstofatoom 12.01 AMU weegt.
* Molaire koolstofmassa: De molaire koolstofmassa is 12,01 g/mol. Dit betekent dat één mol koolstofatomen 12,01 gram weegt.
Relatie:
De atomaire massa en molaire massa zijn direct gerelateerd:
* atomaire massa (AMU) =molaire massa (g/mol)
Sleutelpunt: Met het periodiek systeem kunt u snel de molaire massa van elk element vinden, wat essentieel is voor het uitvoeren van stoichiometrische berekeningen.
 Wat is menselijke zuurgraad?
Wat is menselijke zuurgraad?  Chemici synthetiseren een nieuwe katalysator voor olie- en gasverwerking
Chemici synthetiseren een nieuwe katalysator voor olie- en gasverwerking Wanneer ijzer corrodeert in aanwezigheid van lucht en water om wat te vormen?
Wanneer ijzer corrodeert in aanwezigheid van lucht en water om wat te vormen?  Kunstmatig van kleur veranderend materiaal dat de huid van een kameleon nabootst, kan de versheid van zeevruchten detecteren
Kunstmatig van kleur veranderend materiaal dat de huid van een kameleon nabootst, kan de versheid van zeevruchten detecteren Wat is het resultaat van het toevoegen van loodnitraat aan kaliumjodide?
Wat is het resultaat van het toevoegen van loodnitraat aan kaliumjodide?
 Thais strand uit DiCaprio-film krijgt adempauze van toeristen
Thais strand uit DiCaprio-film krijgt adempauze van toeristen Wie heeft de term hotspots voor het eerst bedacht met betrekking tot biodiversiteit?
Wie heeft de term hotspots voor het eerst bedacht met betrekking tot biodiversiteit?  Het meten van de klimaatimpact van bosbeheer - een baanbrekende aanpak
Het meten van de klimaatimpact van bosbeheer - een baanbrekende aanpak Wie deelt soortgelijke ervaringen met klimaatverandering in een wereld van 1,5 C en daarbuiten?
Wie deelt soortgelijke ervaringen met klimaatverandering in een wereld van 1,5 C en daarbuiten? Wetenschappers helpen de Costa Ricaanse gemeenschap bij het beheren van de slinkende watervoorziening
Wetenschappers helpen de Costa Ricaanse gemeenschap bij het beheren van de slinkende watervoorziening
Hoofdlijnen
- Hoe krijgen we wetenschappelijke kennis?
- Wat is het doel van het vormen van een wetenschappelijke hypothese?
- Welke elementen worden in levende organismen gevonden?
- Sahelanthropus, de oudste vertegenwoordiger van de mensheid, was inderdaad tweevoetig
- Wat regelt de activiteit van het lichaam?
- Waarom wordt wetenschappelijke notatie gebruikt in de wetenschap?
- Wat is schaduwwerk en hoe werkt het?
- Zijn embryonale stamcellen en kunstmatige gelijkwaardig?
- Hoe DNA gekoppeld aan de rol van ribosomen in een cel?
- Onderzoekers ontwikkelen computermodel om te voorspellen of een bestrijdingsmiddel schadelijk is voor bijen

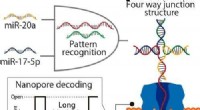
- Nanopore-technologie met DNA-computing detecteert gemakkelijk microRNA-patronen van longkanker
- Bepalen wat bindt aan slijm
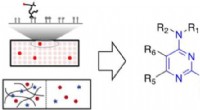
- Nieuwe synthetische eiwitten wedijveren met hun natuurlijke tegenhangers in protonentransport

- Haarverf is giftig - kunnen natuurlijke alternatieven worden gemaakt om te werken?

 De meest nauwkeurige Griekse poging om planetaire beweging uit te leggen was het model van?
De meest nauwkeurige Griekse poging om planetaire beweging uit te leggen was het model van?  Beweegt de aarde in haar baan rond de zon?
Beweegt de aarde in haar baan rond de zon?  Video:Waarom cake donuts en gist donuts zo verschillend zijn
Video:Waarom cake donuts en gist donuts zo verschillend zijn Leg de rol van helium in sterren uit?
Leg de rol van helium in sterren uit?  Wereldwijde natuurrampen richten in 2018 $ 160 miljard schade aan:Munich Re
Wereldwijde natuurrampen richten in 2018 $ 160 miljard schade aan:Munich Re Wat vertraagde de zuurstofvoorziening van de aarde?
Wat vertraagde de zuurstofvoorziening van de aarde? Omvatten atomen moleculeneleverselementen en protonen?
Omvatten atomen moleculeneleverselementen en protonen?  Vier Galileo-satellieten op weg naar een baan op een enkele Ariane 5-raket
Vier Galileo-satellieten op weg naar een baan op een enkele Ariane 5-raket
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

