
Wetenschap
Waar vind je anionen op tipaal op het periodieke tabel?
* groepen 16 en 17 (chalcogenen en halogenen): Deze elementen zijn zeer elektronegatief en hebben de neiging elektronen te krijgen om een stabiele octetconfiguratie te bereiken, waardoor anionen worden gevormd. Voorbeelden zijn zuurstof (o²⁻), zwavel (s²⁻), chloor (CL⁻) en broom (Br⁻).
* Groepen 13, 14 en 15 (niet -metalen): Elementen in deze groepen kunnen ook anionen vormen, vooral wanneer gebonden aan meer elektronegatieve elementen. Voorbeelden zijn stikstof (n³⁻), fosfor (p³⁻) en arseen (as³⁻).
Belangrijke opmerking: Anionen worden niet uitsluitend gevonden aan de rechterkant van het periodiek systeem. Sommige elementen in de overgangsmetalen Kan ook anionen vormen, maar dit komt minder vaak voor.
Vergeet niet dat een anion een negatief geladen ion is, wat betekent dat het een of meer elektronen heeft gekregen. De neiging om anionen te vormen is gerelateerd aan de elektronegativiteit van een element, wat het vermogen is om elektronen in een binding aan te trekken.
 Lee herboren als een kleine zombie-orkaan in de centrale Atlantische Oceaan
Lee herboren als een kleine zombie-orkaan in de centrale Atlantische Oceaan Welke verandering in de atmosfeer van de aarde zorgde ervoor dat organismen op het land konden leven?
Welke verandering in de atmosfeer van de aarde zorgde ervoor dat organismen op het land konden leven?  Wat betekent het lot in wetenschappelijke termen?
Wat betekent het lot in wetenschappelijke termen?  Waarom klimaatverandering op de nieuwsagenda moet blijven staan na wereldwijde toppen
Waarom klimaatverandering op de nieuwsagenda moet blijven staan na wereldwijde toppen Planners buitenspel zetten zorgt voor armer stedelijk beleid, en toekomstige generaties zullen de prijs betalen
Planners buitenspel zetten zorgt voor armer stedelijk beleid, en toekomstige generaties zullen de prijs betalen
Hoofdlijnen
- Is een kristal abiotisch of biotisch?
- Hoe heeft Stephen Gould invloed op de evolutietheorie?
- Wat is een eencellige organismen?
- Wat zijn de vier hoofdfuncties van het skeletstelsel?
- Wetenschappers visualiseren de structuur van de belangrijkste DNA-reparatiecomponent met een bijna-atomaire resolutie
- Klein pincet en gist helpen onderzoekers te laten zien hoe kankermedicijnen werken
- Bronnen van het lactase-enzym
- Curry-kuur? De effectiviteit van een potentiële ziektebestrijder versterken
- Wat is het herstellen van een hypothese?
- Onderzoekers lossen een materiaalmysterie op voor elektronische apparaten van de volgende generatie

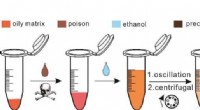
- Ethanolextractie SERS-strategie biedt zeer gevoelige detectie van vergiften in olieachtige matrix
- Het ontdekken van elektrokatalysatoren versnellen met machine learning

- Onderzoekers overwinnen barrières voor functionalisering van bio-geïnspireerde materialen voor het oogsten van zonne-energie

- Zacht maar sterk:biohybride materiaal presteert als kraakbeen
 Kun je een 12V 14AMP -batterij op mijn MZ 125 gebruiken, hoewel de handleiding 9 Amp adviseert. Het is gewoon dat ik weinig extra elektrische bitsfiets wil toevoegen.
Kun je een 12V 14AMP -batterij op mijn MZ 125 gebruiken, hoewel de handleiding 9 Amp adviseert. Het is gewoon dat ik weinig extra elektrische bitsfiets wil toevoegen.  Grafeenschuim detecteert explosieven, emissies beter dan de huidige gassensoren
Grafeenschuim detecteert explosieven, emissies beter dan de huidige gassensoren Energietransitie weg van kolen in China levert voordelen op
Energietransitie weg van kolen in China levert voordelen op Wat gebeurt er als te veel water in een cel zit?
Wat gebeurt er als te veel water in een cel zit?  Verloren graven geïdentificeerd door nieuwe archeologische methoden
Verloren graven geïdentificeerd door nieuwe archeologische methoden Wat is de kracht die je laat versnellen als je valt?
Wat is de kracht die je laat versnellen als je valt?  Hoeveel mol zijn er in 1,8 gram fluor?
Hoeveel mol zijn er in 1,8 gram fluor?  Video:Genieten van de Geminiden van boven en onder
Video:Genieten van de Geminiden van boven en onder
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

