
Wetenschap
Waarom verplaatst chloor broom van kaliumbromide?
* elektronegativiteit: Chloor is meer elektronegatief dan broom. Dit betekent dat chloor een sterkere aantrekkingskracht heeft op elektronen.
* Reactiviteit: Hogere elektronegativiteit vertaalt zich in een grotere reactiviteit. Chloor, dater reactiever, zal elektronen gemakkelijk wegtrekken van broom in de kaliumbromide -verbinding.
* reactie: De reactie tussen chloor en kaliumbromide is een enkele verplaatsingsreactie:
cl₂ (g) + 2kBr (aq) → 2kcl (aq) + br₂ (l)
* Chloor (CL₂) reageert met kaliumbromide (KBR).
* Chloor neemt de plaats in van broom in de verbinding en vormt kaliumchloride (KCL).
* Bromine (Br₂) wordt vrijgegeven als een vloeistof.
In wezen kan de sterkere trek van chloor in de elektronen de bromine uit de compound "schoppen" en een nieuwe verbinding met kalium vormen. Deze reactie wordt aangedreven door de neiging van elementen om een stabielere elektronenconfiguratie te bereiken.
 Wat is de bijdrage van Julius Lothar Meyer aan het periodieke tabel?
Wat is de bijdrage van Julius Lothar Meyer aan het periodieke tabel?  Wat zijn voorbeelden van anorganische verbindingen?
Wat zijn voorbeelden van anorganische verbindingen?  Wat voor soort reactie gebeurt er met zoutzuur en Alka Seltzer?
Wat voor soort reactie gebeurt er met zoutzuur en Alka Seltzer?  Energie-efficiënte fotochemie op zonne-energie met luminescente zonneconcentratoren
Energie-efficiënte fotochemie op zonne-energie met luminescente zonneconcentratoren Onderzoekers gebruiken licht om snelle chemische reacties op een nieuwe manier te beheersen
Onderzoekers gebruiken licht om snelle chemische reacties op een nieuwe manier te beheersen
 Drogere omstandigheden kunnen de sparren en sparren van Rocky Mountain verdoemen
Drogere omstandigheden kunnen de sparren en sparren van Rocky Mountain verdoemen Een aardbeving met een kracht van 7,2 op de schaal van Richter treft Haïti; minstens 227 doden
Een aardbeving met een kracht van 7,2 op de schaal van Richter treft Haïti; minstens 227 doden Energiegerelateerde koolstofemissies stegen in de VS in 2018:studie
Energiegerelateerde koolstofemissies stegen in de VS in 2018:studie De omgeving verbeteren:wanneer oplossingen problemen worden
De omgeving verbeteren:wanneer oplossingen problemen worden Bewoners keren terug naar door storm geteisterde Florida Keys
Bewoners keren terug naar door storm geteisterde Florida Keys
Hoofdlijnen
- Nieuwe ontdekking vergroot het begrip van hoe planten en bacteriën licht zien
- Wat is het systeem voor het benoemen van organismen waarin elk organisme een unieke tweedelige wetenschappelijke naam kreeg?
- Wetenschappers verhelderen substraatherkenning en protonkoppelingsmechanisme van transporteiwit VMAT2
- Een 'B12-shot' voor zeealgen? Wetenschappers vinden de groei van belangrijke eiwitalgen in de oceaan
- Geen microben? probleem voor rupsen
- Onderzoekers bepalen hoe muggen een dengue-virusinfectie overleven
- Wat hebben de Grieken bijgedragen aan de wetenschap?
- Wat is de functie van een celwand een dierencel?
- Natuurlijke stoffen zijn veelbelovend tegen het coronavirus
- Wetenschappers ontwikkelen een methode om gevaarlijk zuur industrieel afvalwater om te zetten in waardevolle hulpbronnen
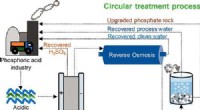
- Bruggen bouwen met watermoleculen

- De nieuwe alchemie in koolstofneutraliteit:water omzetten in ammoniak met alleen hernieuwbare energie
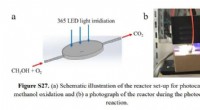
- Efficiëntie in fotokatalyse bleek plaatsgevoelig te zijn
- Nog een reden om van de gestreepte bas te houden:antimicrobiële middelen

 Waarom concluderen astronomen dat de korst op Mars dikker moet zijn dan aardkorst?
Waarom concluderen astronomen dat de korst op Mars dikker moet zijn dan aardkorst?  Verstrengeling door een glasvezelkabel met hoge betrouwbaarheid aantonen
Verstrengeling door een glasvezelkabel met hoge betrouwbaarheid aantonen Wie zijn de eerste mensen die naar de maan gaan?
Wie zijn de eerste mensen die naar de maan gaan?  Zijn sommige steden sympathieker dan andere?
Zijn sommige steden sympathieker dan andere?  Onderzoek naar plantenchemie onderzoekt trends in vergroening
Onderzoek naar plantenchemie onderzoekt trends in vergroening Polaire zwerven op dwergplaneet Ceres onthuld
Polaire zwerven op dwergplaneet Ceres onthuld Hoeveel liter zijn 4 kopjes plus 2 pinten gelijk?
Hoeveel liter zijn 4 kopjes plus 2 pinten gelijk?  Kenmerkende benadering onthult gewaardeerde eigenschap in nanoscopisch materiaal
Kenmerkende benadering onthult gewaardeerde eigenschap in nanoscopisch materiaal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

