
Wetenschap
Waarom heeft chroom een hoog kookpunt?
* Sterke metalen binding: Chroom vertoont sterke metalen binding vanwege de aanwezigheid van een groot aantal delocaliseerde elektronen in zijn structuur. Deze elektronen vormen een "zee" van elektronen die de metaalatomen bij elkaar houden door elektrostatische aantrekkingskracht. Deze sterke binding vereist een aanzienlijke hoeveelheid energie om te breken, wat resulteert in een hoog kookpunt.
* Hoog smeltpunt: Chroom heeft een hoog smeltpunt (1907 ° C), dat direct gerelateerd is aan zijn sterke metalen binding. Het hoge smeltpunt draagt ook bij aan het hoge kookpunt, omdat het metaal sterke interatomische krachten moet overwinnen naar overgang van vaste naar vloeistof en vervolgens van vloeibaar naar gas.
* Kleine atoomradius: Chroom heeft een relatief kleine atoomradius, wat betekent dat de atomen stevig aan elkaar zijn verpakt. Deze nabijheid versterkt de metaalbinding verder en draagt bij aan het hoge kookpunt.
* Hoge verdampingsthalpie: Chroom heeft een hoge enthalpie van verdamping, wat betekent dat een grote hoeveelheid energie vereist is om deze van een vloeistof naar een gas om te zetten. Dit komt omdat de sterke metalen bindingen moeten worden verbroken om de aantrekkelijke krachten tussen de atomen te overwinnen.
Samenvattend: Het hoge kookpunt van Chromium is een gevolg van zijn sterke metalen binding, hoog smeltpunt, kleine atoomradius en hoge enthalpie van verdamping. Al deze factoren dragen bij aan de hoge energie die nodig is om de interatomische krachten en overgangchroom te overwinnen van een vaste stof naar een vloeistof en vervolgens van een vloeistof naar een gas.
 Wat zijn de 5 toepassingen van magnetisme?
Wat zijn de 5 toepassingen van magnetisme?  Cryo-EM onthult interactie tussen belangrijke medicijndoelen
Cryo-EM onthult interactie tussen belangrijke medicijndoelen Chemici vinden een efficiënte thermische camera uit om de kosten van chemisch onderzoek te verlagen
Chemici vinden een efficiënte thermische camera uit om de kosten van chemisch onderzoek te verlagen Waarom pH-sondes altijd ondergedompeld blijven in 3M Kcl-oplossing?
Waarom pH-sondes altijd ondergedompeld blijven in 3M Kcl-oplossing?  Welke diatomee elementen zijn gassen bij kamertemperatuur?
Welke diatomee elementen zijn gassen bij kamertemperatuur?
 Om het klimaat te redden, koolstof belasten tegen $ 75 per ton:IMF
Om het klimaat te redden, koolstof belasten tegen $ 75 per ton:IMF Sierra Nevada Mountain Feiten voor kinderen
Sierra Nevada Mountain Feiten voor kinderen  Verloren continent Zeelandia:wetenschappers keren terug van expeditie naar gezonken land
Verloren continent Zeelandia:wetenschappers keren terug van expeditie naar gezonken land Onderzoek door zeevogels van atollen in de Indo-Pacifische regio toont hun enorme impact op vogelpopulaties en nestplaatsen
Onderzoek door zeevogels van atollen in de Indo-Pacifische regio toont hun enorme impact op vogelpopulaties en nestplaatsen  Hoe Charles Darwin werkte
Hoe Charles Darwin werkte
Hoofdlijnen
- Welke verklaring ondersteunt het feit dat botcellen kleiner zijn dan weefsel?
- Wat zijn de belangrijkste intermoleculaire krachten van xenon?
- Wat gebeurt er met een cel als deze veel water verliest?
- Waarom heeft het menselijk lichaam geen eiwitten opslag?
- Hoe zijn en archaea vergelijkbaar hoe ze verschillen?
- Wat is de hypothese die de beweging van vloeistof door floëem in een plant verklaart?
- Zijn huidcellen het snelst groeiende type van het menselijk organisme?
- Verlichting aan het water verstoort de natuur in het omliggende ecosysteem drastisch
- Wat denk je dat er met een dierlijke cel zal gebeuren als het membraan barst, zou hetzelfde gebeuren met een plantencel?
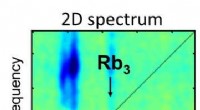
- Onderzoekers passen voor het eerst 2D-spectroscopie toe op geïsoleerde moleculaire systemen
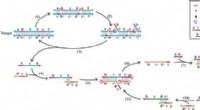
- Eenvoudig kopiëren:een universele isotherme DNA-amplificatiemethode
- Lithium-ionbatterijen krijgen meer efficiëntie dankzij silicium, germanium, koolstof nanowalls

- Innovatie verandert spinnenwebarchitectuur in 3D-beeldvormingstechnologie

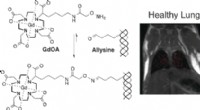
- Niet-invasieve magnetische resonantiebeeldvorming van longfibrogenese met een op aminozuren gerichte sonde
 Een probioticum voor onze longen? Nieuw onderzoek roept vragen op over de toekomst van de behandeling van COVID-19
Een probioticum voor onze longen? Nieuw onderzoek roept vragen op over de toekomst van de behandeling van COVID-19  Hoe is het vermogen om te corroderen?
Hoe is het vermogen om te corroderen?  SpaceX gaat eerste satellieten van zijn internetnetwerk lanceren
SpaceX gaat eerste satellieten van zijn internetnetwerk lanceren Bijna 800 archeologische vondsten gestolen uit Italië terug
Bijna 800 archeologische vondsten gestolen uit Italië terug Welke kenmerken maken Jupiter gemakkelijk te herkennen?
Welke kenmerken maken Jupiter gemakkelijk te herkennen?  Nieuwe kaarten laten zien dat de krimpende wildernis op eigen risico wordt genegeerd
Nieuwe kaarten laten zien dat de krimpende wildernis op eigen risico wordt genegeerd Kunnen ziektedetecterende honden de dikhoornschapen in South Dakota helpen redden?
Kunnen ziektedetecterende honden de dikhoornschapen in South Dakota helpen redden?  Waarom is er geen vrije rotatie rond een dubbele binding?
Waarom is er geen vrije rotatie rond een dubbele binding?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

