
Wetenschap
Wat gebeurt er als metalen reageren met andere elementen de atomen van metaal?
1. Metallic binding en de "zee van elektronen"
* metalen: Metalen hebben een unieke structuur waar hun buitenste elektronen losjes worden vastgehouden. Deze elektronen zijn in wezen vrij om door het metalen rooster te bewegen en vormen wat een "zee van elektronen" wordt genoemd.
* binding: Deze "zee" van elektronen werkt als een lijm en houdt de metaalionen bij elkaar in een sterke metalen binding.
2. Reacties met niet -metalen:vorming van ionen en ionische bindingen
* verlies van elektronen (oxidatie): Wanneer metalen reageren met niet -metalen, verliezen ze de neiging elektronen van hun buitenste schaal te verliezen. Dit proces wordt oxidatie genoemd.
* Vorming van positieve ionen (kationen): Door elektronen te verliezen, worden metaalatomen positief geladen ionen (kationen).
* winst van elektronen (reductie): Niet -metalen daarentegen winnen deze elektronen en worden negatief geladen ionen (anionen).
* ionische binding: De elektrostatische aantrekkingskracht tussen deze tegengesteld geladen ionen vormt een sterke ionische binding.
Voorbeeld:natrium (NA) reageren met chloor (CL)
* Natrium (NA) heeft één losjes elektron vastgehouden in zijn buitenste schaal.
* Chloor (CL) heeft zeven elektronen in de buitenste schaal en heeft er nog een nodig om stabiel te worden.
* Natrium verliest zijn elektron aan chloor en vormt een natriumkation (Na+) en een chloride-anion (Cl-).
* Deze ionen trekken elkaar sterk aan en vormen natriumchloride (NaCl), een gemeenschappelijk tafelzout.
3. Reacties met andere metalen:vorming van legeringen
* legeringsvorming: Metalen kunnen ook reageren met andere metalen, waardoor mengsels worden genoemd die legeringen worden genoemd.
* Nieuwe eigenschappen: Legeringen hebben vaak verschillende eigenschappen dan de individuele metalen waar ze van zijn gemaakt, zoals verhoogde sterkte, hardheid of weerstand tegen corrosie.
Belangrijke punten om te onthouden:
* oxidatie: Metaalatomen verliezen meestal elektronen in reacties.
* ionische bindingen: Metalen vormen ionische bindingen met niet -metalen.
* legeringen: Metalen kunnen legeringen vormen met andere metalen.
* Elektronenconfiguratie: De elektronenconfiguratie van het metaalatoom bepaalt hoe gemakkelijk het elektronen verliest.
Laat het me weten als je specifieke voorbeelden wilt verkennen of dieper in een van deze concepten wilt duiken!
 Hoge-resolutiestructuren van het archaerhodopsine-3-eiwit werpen nieuw licht op receptordesensibilisatie
Hoge-resolutiestructuren van het archaerhodopsine-3-eiwit werpen nieuw licht op receptordesensibilisatie Zelfsteriliserend polymeer blijkt effectief tegen medicijnresistente pathogenen
Zelfsteriliserend polymeer blijkt effectief tegen medicijnresistente pathogenen Hoe kernfusiereactoren werken
Hoe kernfusiereactoren werken  Van welke stof zijn de buitenplaneten meestal samengesteld?
Van welke stof zijn de buitenplaneten meestal samengesteld?  Wat is de formule voor een ionische verbinding die is gevormd uit aluminium en zuurstof?
Wat is de formule voor een ionische verbinding die is gevormd uit aluminium en zuurstof?
 Wat leeft er in een bos, beweegt niet botten en is groenachtig grijsachtig?
Wat leeft er in een bos, beweegt niet botten en is groenachtig grijsachtig?  Geen terugkeer naar Eden:onderzoekers onderzoeken hoe soorten kunnen worden hersteld in een veranderende wereld
Geen terugkeer naar Eden:onderzoekers onderzoeken hoe soorten kunnen worden hersteld in een veranderende wereld  Tyfoon Mangkhut treft miljoenen in Filipijnen
Tyfoon Mangkhut treft miljoenen in Filipijnen Macedonië legt dringende maatregelen op vanwege ernstige vervuiling
Macedonië legt dringende maatregelen op vanwege ernstige vervuiling In het Caribisch gebied, kolonialisme en ongelijkheid betekenen dat orkanen harder toeslaan
In het Caribisch gebied, kolonialisme en ongelijkheid betekenen dat orkanen harder toeslaan
Hoofdlijnen
- Welke organismen hebben vier kamer met een kamer?
- UITLEG:Wat maakt zangvogels uit het midden van de Atlantische Oceaan ziek?
- Waarom algen Thales genaamd?
- Onderzoek identificeert een nieuw mechanisme dat betrokken is bij de voortplantingsfunctie
- Verschillen tussen huisdiertraining en dierenconditionering
- Wat is de rol van een hart enzym?
- Zijn dubbelgangers echt? Er is een kans van 1 op een biljoen
- Team onthult regels voor het maken van ribben
- Hoe konden gelelektroforese worden gebruikt om te zien of een genetische modificatie -experiment succesvol was?
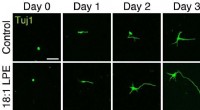
- Oleoyl-LPE oefent neurietstimulatie en neuroprotectie uit
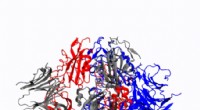
- Chemicus ontwikkelt 3D-simulaties van coronavirus-spike-eiwitten
- Onderzoekers maken kunstmatig parelmoer met behulp van bacteriën

- De milieukosten van fast fashion

- Nieuwe inkjetprintmethode kan het ontdekken van medicijnen en geprinte gepersonaliseerde medicijnafgifte versnellen

 Wat stopt stromen in glasachtige materialen?
Wat stopt stromen in glasachtige materialen? De manier waarop we voor het milieu zorgen, kan sociale gevolgen hebben
De manier waarop we voor het milieu zorgen, kan sociale gevolgen hebben  Mysterieus robotvliegtuig vliegt 500 dagen in de ruimte; wat doet het?
Mysterieus robotvliegtuig vliegt 500 dagen in de ruimte; wat doet het?  Chinees team ontwikkelt huidachtige tribo-elektrische nanogenerator
Chinees team ontwikkelt huidachtige tribo-elektrische nanogenerator Quantum dots maken de sprong van tv's naar antibacteriële oogdruppels
Quantum dots maken de sprong van tv's naar antibacteriële oogdruppels Als wereldleiders elkaar ontmoeten, het Amazone-regenwoud brandt af
Als wereldleiders elkaar ontmoeten, het Amazone-regenwoud brandt af Als ademhaling koolstofdioxide en water produceert, wat gebeurt er dan met deze producten voor dat ze in het lichaam worden opgebouwd?
Als ademhaling koolstofdioxide en water produceert, wat gebeurt er dan met deze producten voor dat ze in het lichaam worden opgebouwd?  Vliegen door rookpluimen van bosbranden kan de rookvoorspellingen verbeteren
Vliegen door rookpluimen van bosbranden kan de rookvoorspellingen verbeteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

