
Wetenschap
Wat betekent het om te neutraliseren in zuren en basen?
Hier is een uitsplitsing:
zuren: Zuren zijn stoffen die waterstofionen (H+) vrijgeven wanneer opgelost in water. Ze hebben een zure smaak en kunnen blauw lakmoespapier rood worden.
Bases: Bases zijn stoffen die hydroxide-ionen (OH-) vrijgeven wanneer opgelost in water. Ze hebben een bittere smaak en kunnen rood lakmoespapier blauw worden.
Neutralisatiereactie:
Wanneer een zuur reageert met een basis, combineren de waterstofionen van het zuur met de hydroxide -ionen van de basis om water te vormen (H2O). De resterende ionen vormen een zout.
Voorbeeld:
* HCl (zoutzuur) + NaOH (natriumhydroxide) → NaCl (natriumchloride) + H2O (water)
In dit voorbeeld reageert zoutzuur (HCL) met natriumhydroxide (NaOH). De waterstofionen (H+) van HCl combineren met de hydroxide-ionen (OH-) van NaOH om water te vormen (H2O). De resterende ionen, natrium (Na+) en chloride (Cl-), vormen natriumchloride (NaCl), wat een zout is.
Sleutelpunten:
* pH -schaal: De pH -schaal meet de zuurgraad of alkaliteit van een oplossing. Een neutrale oplossing heeft een pH van 7. Zuren hebben een pH van minder dan 7, terwijl basen een pH groter dan 7 hebben.
* Neutralisatieresultaten: Neutralisatiereacties produceren een oplossing met een pH dichter bij 7, waardoor deze minder zuur of basic is.
* Toepassingen: Neutralisatiereacties worden in veel toepassingen gebruikt, waaronder:
* Voedselproductie: Neutraliseren van overtollig zuur in voedselproducten.
* Afvalwaterzuivering: Neutralisatie van zuur of eenvoudig afvalwater.
* Drugsontwikkeling: Het neutraliseren van zure of basisgeneesmiddelen om hun stabiliteit en absorptie te verbeteren.
Laat het me weten als je meer details wilt over een specifiek aspect van neutralisatie!
 Wetenschapper:de omvang van het dumpen van DDT in de Stille Oceaan is enorm
Wetenschapper:de omvang van het dumpen van DDT in de Stille Oceaan is enorm Australische vulkaanuitbarsting kan voortleven in Aboriginalverhalen
Australische vulkaanuitbarsting kan voortleven in Aboriginalverhalen Hoe een Copperhead Vs. te identificeren een melkslang
Hoe een Copperhead Vs. te identificeren een melkslang  Cultureel verzet:is LGBTQ-vooruitgang een aanval op het christendom?
Cultureel verzet:is LGBTQ-vooruitgang een aanval op het christendom?  Hoe zal de koolstofcyclus van de oceaan in de toekomst evolueren? Nieuw project is bedoeld om erachter te komen
Hoe zal de koolstofcyclus van de oceaan in de toekomst evolueren? Nieuw project is bedoeld om erachter te komen
Hoofdlijnen
- Komt celafval voort uit activiteiten?
- Kwallen hebben superkrachten - en andere redenen waarom ze hun slechte reputatie niet verdienen
- Onderzoek toont een manier om een gemeenschappelijke basis te creëren over gen-editing
- Wat is de volgorde van het neurale pad?
- Onthullen hoe het genoom zichzelf heeft gecondenseerd in het virus
- Wat creëerde de eerste levende micro -organismen op aarde?
- Onderzoekers identificeren afweermechanisme van malariaparasiet
- De productie van recombinante menselijke groeihormonen door Recombinant DNA Technology
- Nachtvliegers of dagjesmensen? Studie werpt licht op wanneer motten, vlinders zijn actief
- Nieuwe 3D-röntgentechniek onthult geheimen van binnenuit botten

- Nieuwe ontdekkingen en inzichten in de glasovergang
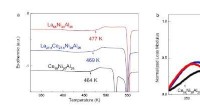
- Een nieuwe bètavoltaïsche technologie met kleurstoffen voor een betere energieproductie

- Een nieuwe manier om zachte robots te maken:DNA-triggers die ervoor zorgen dat hydrogels van vorm veranderen

- RNA-basisbouwsteen voor het eerst biokatalytisch geproduceerd
 Symbiotische relaties in koraalriffen
Symbiotische relaties in koraalriffen  Ingenieurs ontwikkelen op grafeen gebaseerde biosensor die op drie manieren tegelijk werkt
Ingenieurs ontwikkelen op grafeen gebaseerde biosensor die op drie manieren tegelijk werkt Hoe de concentratie te vinden wanneer u de pH
Hoe de concentratie te vinden wanneer u de pH Hoe werken organellen in prokaryotische cellen samen?
Hoe werken organellen in prokaryotische cellen samen?  Wat is de naam van Achiplago op Equator?
Wat is de naam van Achiplago op Equator?  6 steenkoude feiten over de poolcirkel
6 steenkoude feiten over de poolcirkel  Hoe face-to-face Facebook nog steeds verslaat:Beperkingen op de omvang van onze offline sociale groepen gelden ook online
Hoe face-to-face Facebook nog steeds verslaat:Beperkingen op de omvang van onze offline sociale groepen gelden ook online  Hongaarse wetenschappers gealarmeerd door geplande overname door de overheid
Hongaarse wetenschappers gealarmeerd door geplande overname door de overheid
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

