
Wetenschap
Wat zijn stoffen die H uit een oplossing verwijderen?
Dit is waarom:
* zuren Doneer H+ ionen (protonen) aan een oplossing, waardoor de concentratie van H+ -ionen wordt verhoogd.
* bases Accepteer H+ ionen uit een oplossing, waardoor de concentratie van H+ -ionen wordt verminderd.
Er zijn verschillende manieren waarop bases h+ uit een oplossing kunnen verwijderen:
* Hydroxide-ionen (OH-) Reageer direct met H+ ionen om water te vormen:
* H + + OH- -> H2O
* Andere bases Kan reageren met H+ om een nieuwe verbinding te vormen, waardoor de H+ effectief uit oplossing worden verwijderd.
Voorbeelden van bases:
* Natriumhydroxide (NaOH) - Een sterke basis die gemakkelijk in water dissocieert om oh-ionen te vormen.
* ammoniak (NH3) - Een zwakke basis die reageert met water om ammonium (NH4+) ionen en OH-ionen te vormen.
* calciumcarbonaat (caco3) - Een vaste basis die reageert met zuren om ze te neutraliseren.
Opmerking: De kracht van een basis verwijst naar zijn vermogen om H+ -ionen te accepteren. Sterke basen dissociëren volledig in water, terwijl zwakke bases slechts gedeeltelijk dissociëren.
 Hoe e-waste concurrenten aanmoedigt om samen te werken
Hoe e-waste concurrenten aanmoedigt om samen te werken Antarctisch zee-ijs 2016, recordlaagte door perfecte storm van tropische, polaire omstandigheden
Antarctisch zee-ijs 2016, recordlaagte door perfecte storm van tropische, polaire omstandigheden Studie:Zoutmoerassen zullen verdwijnen als de zeeën blijven stijgen en Californië blijft bouwen
Studie:Zoutmoerassen zullen verdwijnen als de zeeën blijven stijgen en Californië blijft bouwen Welke 3 dingen breng je altijd aan wetenschap calss?
Welke 3 dingen breng je altijd aan wetenschap calss?  Menselijk gedrag saboteert koolstofdioxide-reducerende strategieën
Menselijk gedrag saboteert koolstofdioxide-reducerende strategieën
Hoofdlijnen
- Wat is het koolhydraatsubstraat dat wordt aangetroffen in sommige getarteld molecuul met dierenweefsels en elke tak gevormd uit ongeveer 10-20 glucose-eenheden?
- Hoe bergstromen klimaatverandering signaleren
- Gaat de celdeling alleen voor bij vrouwen?
- Hoe de lengte van DNA-fragmenten te berekenen
- Is het Mexicaanse gen sterker dan het Filipijnse gen?
- Herbivoren helpen ecosystemen te beschermen tegen klimaatverandering
- Wat is het eerste enzym dat zich met voedsel in het spijsverteringssysteem mengt?
- Wat is de functie van een irisdiafragmamicroscoop?
- Waarom worden chloroplasten als koolhydraatfabrieken en ribosomen beschouwd als eiwitfabrieken?
- Nieuw proces kan 3D-geprinte materialen met 200 procent versterken

- Chemici ontwikkelen een methode om verbindingen voor geneesmiddelen te synthetiseren
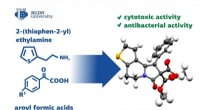
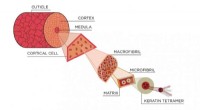
- Een oplossing voor een harig probleem in de forensische wetenschap
- Ontdekking onthult noodzaak voor ammoniakemissieregelgeving

- Een nieuw systeem om een verbinding te bouwen die cruciaal is voor de ontwikkeling van geneesmiddelen

 Wat zijn 3 metingen met verschillende eenheden die gelijk zijn aan 5 meter?
Wat zijn 3 metingen met verschillende eenheden die gelijk zijn aan 5 meter?  Wie is jouw papa? Mannelijke zeepaardjes transporteren voedingsstoffen naar embryo's
Wie is jouw papa? Mannelijke zeepaardjes transporteren voedingsstoffen naar embryo's  De gevangenis is een ramp voor vrouwen. Dit is wat in plaats daarvan zou kunnen werken
De gevangenis is een ramp voor vrouwen. Dit is wat in plaats daarvan zou kunnen werken  Waarom zijn onverzadigde vetten vloeibaar bij kamertemperatuur?
Waarom zijn onverzadigde vetten vloeibaar bij kamertemperatuur?  Egelaanpassing
Egelaanpassing  Wat zijn de vier belangrijkste gassen in de lucht, in volgorde van afnemende dichtheid?
Wat zijn de vier belangrijkste gassen in de lucht, in volgorde van afnemende dichtheid?  Exoplaneten 101:Op zoek naar leven buiten ons zonnestelsel
Exoplaneten 101:Op zoek naar leven buiten ons zonnestelsel Hoe creëren verschillen in vloeistofdruk een drijfvermogen?
Hoe creëren verschillen in vloeistofdruk een drijfvermogen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

