
Wetenschap
Welk type binding is tussen metalen met niet -metalen verschillende elektronegativiteiten?
Dit is waarom:
* elektronegativiteit: Elektronegativiteit is de maat voor het vermogen van een atoom om elektronen in een binding aan te trekken. Niet -metalen hebben over het algemeen een hogere elektronegativiteit dan metalen.
* elektronenoverdracht: Wanneer een metaal interageert met een niet -metaal, zorgt de hogere elektronegativiteit van het niet -metaal ervoor dat het een of meer elektronen uit het metaalatoom "steelt". Dit resulteert in de vorming van ionen:een positief geladen metaalion (kation) en een negatief geladen niet -metaalion (anion).
* Elektrostatische aantrekkingskracht: De tegengesteld geladen ionen worden vervolgens tot elkaar aangetrokken door sterke elektrostatische krachten en vormen een ionische binding.
Voorbeeld:
* natrium (Na) en chloor (CL): Natrium heeft een lage elektronegativiteit, terwijl chloor een hoge elektronegativiteit heeft. Wanneer ze reageren, verliest natrium een elektron om een positief geladen natriumion (Na+) te worden, en chloor krijgt een elektron om een negatief geladen chloride-ion (Cl-) te worden. Deze ionen vormen vervolgens een ionische binding om natriumchloride (NaCl) te creëren, beter bekend als tafelzout.
 Zal het mengen van Clorox en remvloeistof echt een explosie veroorzaken?
Zal het mengen van Clorox en remvloeistof echt een explosie veroorzaken?  Voorkomen van roest met coatings
Voorkomen van roest met coatings  Wanneer sommige ionische verbindingen oplossen, dissociëren niet al hun bindingen. Wat voor soort geleidbaarheid zou je verwachten dat een dergelijke oplossing zou hebben?
Wanneer sommige ionische verbindingen oplossen, dissociëren niet al hun bindingen. Wat voor soort geleidbaarheid zou je verwachten dat een dergelijke oplossing zou hebben?  Als je slijm maakt, kun je dan zout gebruiken in plaats van borax?
Als je slijm maakt, kun je dan zout gebruiken in plaats van borax?  Welke macromoleculen zijn er in korrels?
Welke macromoleculen zijn er in korrels?
 Onderzeese vulkanen dragen bij aan oceaangeluid
Onderzeese vulkanen dragen bij aan oceaangeluid Identificeer drie factoren die de balans van een ecosysteem regelen?
Identificeer drie factoren die de balans van een ecosysteem regelen?  Aswolken van Antarctische vulkanen kunnen het luchtverkeer op het zuidelijk halfrond verstoren
Aswolken van Antarctische vulkanen kunnen het luchtverkeer op het zuidelijk halfrond verstoren Het is tijd om accountants te trainen in duurzaamheid
Het is tijd om accountants te trainen in duurzaamheid Antropogene grondwaterwinning heeft invloed op het klimaat
Antropogene grondwaterwinning heeft invloed op het klimaat
Hoofdlijnen
- Verstikt, gewurgd en verdronken. Hoe plastic zakken met ballonnen zeedieren doden
- Eenheid van inherent in dat wordt doorgegeven van ouder tot nakomelingen?
- Wat doet een mitochodria in de plantencel?
- Welke vaardigheden krijg je van de wetenschap?
- DNA-replicatie vergelijken en contrasteren in prokaryoten en eukaryoten
- Suikergom staat bekend als riskante takdruppelaars, maar is belangrijk voor bijen, papegaaien en buidelratten.
- Factoren die van invloed zijn op celverdeling
- Wetenschappers ontwikkelen microben om herinneringen aan hun omgeving te vormen
- Waar in het lichaam wordt lipase geproduceerd?
- Wetenschappers betwijfelen of DeepMinds AI net zo goed is voor fractionele ladingssystemen als het lijkt

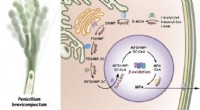
- Mysterie van de biosynthese van immunosuppressiva eindelijk ontgrendeld
- Zuurstofreducerende enzymen begrijpen

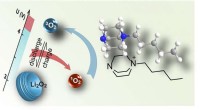
- Coördinatiepolymeerglas biedt solide ondersteuning voor waterstofbrandstofcellen

- Batterijonderzoek:nieuwe doorbraken in onderzoek naar superbatterijen
 Kun je schilderen over een zinkcoated stalen gastank om het te beschermen tegen roesten?
Kun je schilderen over een zinkcoated stalen gastank om het te beschermen tegen roesten?  Eén op de duizend jaar? Oude overstromingskansen houden geen water meer vast
Eén op de duizend jaar? Oude overstromingskansen houden geen water meer vast  Moet stemmen verplicht worden of moeten we het recht hebben om niet te stemmen?
Moet stemmen verplicht worden of moeten we het recht hebben om niet te stemmen?  Wat zijn helling canyons?
Wat zijn helling canyons?  Ontsluiten van kwantumcomputerkracht:geautomatiseerd protocolontwerp voor kwantumvoordeel
Ontsluiten van kwantumcomputerkracht:geautomatiseerd protocolontwerp voor kwantumvoordeel  Waar bevindt de kern zich in plantencel?
Waar bevindt de kern zich in plantencel?  Begrijpen hoe kleine organische ionen gouden nanodeeltjes stabiliseren, kan een betere controle mogelijk maken
Begrijpen hoe kleine organische ionen gouden nanodeeltjes stabiliseren, kan een betere controle mogelijk maken Hoeveel mol water H2O wordt geproduceerd uit de reactie van 16 gram methaan CH4 met een onbeperkte voeding Oxygen O2. Is dit?
Hoeveel mol water H2O wordt geproduceerd uit de reactie van 16 gram methaan CH4 met een onbeperkte voeding Oxygen O2. Is dit?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

