
Wetenschap
Welk type binding heeft een hoge elektronegativiteit?
Dit is waarom:
* elektronegativiteit is de maat voor het vermogen van een atoom om elektronen naar zichzelf aan te trekken in een chemische binding.
* Polaire covalente bindingen komen op wanneer er een significant verschil is in elektronegativiteit tussen twee atomen. Dit verschil zorgt ervoor dat de elektronen ongelijk worden gedeeld, waardoor een gedeeltelijke positieve lading ontstaat op het ene atoom en een gedeeltelijke negatieve lading aan het andere.
Voorbeelden:
* De binding tussen zuurstof (hoge elektronegativiteit) en waterstof (lage elektronegativiteit) in water (H₂O) is een polaire covalente binding. Het zuurstofatoom trekt de gedeelde elektronen dichter bij zichzelf, waardoor het enigszins negatief is, terwijl de waterstofatomen enigszins positief worden.
daarentegen:
* Niet -polaire covalente bindingen Optreden wanneer het elektronegativiteitsverschil tussen twee atomen erg klein of nul is. De elektronen worden gelijk gedeeld.
* ionische bindingen Vorm wanneer er een groot elektronegativiteitsverschil is, waardoor het ene atoom in wezen een elektron aan het andere opgeeft, waardoor een volledige positieve en een volledige negatieve lading ontstaat.
Dus, hoewel elektronegativiteit een eigenschap is van individuele atomen, beïnvloedt het direct het -type van binding gevormd tussen hen, met polaire covalente bindingen die de hoogste elektronegativiteitsverschillen vertonen.
 Planten en bomen die je in het bos vindt
Planten en bomen die je in het bos vindt Studie onderzoekt blootstelling binnenshuis aan luchtvervuiling
Studie onderzoekt blootstelling binnenshuis aan luchtvervuiling Hoe diepzee-openingen enorme fytoplanktonbloei voeden
Hoe diepzee-openingen enorme fytoplanktonbloei voeden Model suggereert dat goed ontworpen subsidies boeren kunnen helpen en consumenten betere voedselkeuzes kunnen geven
Model suggereert dat goed ontworpen subsidies boeren kunnen helpen en consumenten betere voedselkeuzes kunnen geven Kevers die op Lady Bugs lijken
Kevers die op Lady Bugs lijken
Hoofdlijnen
- Geef de haaien niet de schuld:uit onderzoek blijkt waarom er steeds meer gehaakte tarpoenen worden gegeten
- Vijf redenen om de insecten in je tuin niet te besproeien
- Hoe verslaving werkt
- Waarom veranderen theorieën of hypothese in de wetenschap?
- Werkkopieën van een gen rechtstreeks invoegen in de cellen persoon met genetische aandoening wordt wat genoemd?
- Hoe sperma het genoom van vader uitpakt, zodat het kan samensmelten met dat van moeder
- Waarmee combineert adenine in RNA?
- Wat is Bryophyllum kort uitgelegd?
- Hoe vleermuizen het menselijk brein helpen verklaren
- Polymerisatieproces van hydrogelmicrosferen op video

- Onderzoekers rapporteren een temperatuurgevoelige gel die vocht absorbeert en afgeeft
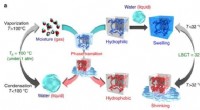
- Nieuwe verwerkingstechniek kan aardappelen gezonder maken
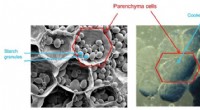
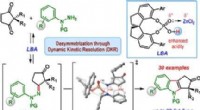
- Enantioselectieve synthese van indoolderivaten
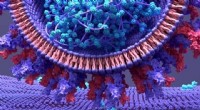
- Nieuwe tool om het ontdekken van medicijnen te versnellen
 Hoe waterkrachtcentrales werken
Hoe waterkrachtcentrales werken  Wetenschappers waarschuwen dat droogte in het westen van de VS nieuw normaal kan zijn
Wetenschappers waarschuwen dat droogte in het westen van de VS nieuw normaal kan zijn  Wat zijn de 3 soorten rotsen die de korst vormen?
Wat zijn de 3 soorten rotsen die de korst vormen?  Een laag vermogen, zeer responsieve en herbruikbare zweet-pH-monitor
Een laag vermogen, zeer responsieve en herbruikbare zweet-pH-monitor Wat gebruikt Neil deGrasse Tyson als een metafoor voor hoe we worden geboren in het universum van mysterie?
Wat gebruikt Neil deGrasse Tyson als een metafoor voor hoe we worden geboren in het universum van mysterie?  Onderzoek verbetert droog smeermiddel dat wordt gebruikt in machines en biomedische apparaten
Onderzoek verbetert droog smeermiddel dat wordt gebruikt in machines en biomedische apparaten Waarom breidt het metaal uit wanneer het wordt verwarmd?
Waarom breidt het metaal uit wanneer het wordt verwarmd?  Wat bereikte het centrum van de zonnevran de temperaturen die heet genoeg waren om te veroorzaken?
Wat bereikte het centrum van de zonnevran de temperaturen die heet genoeg waren om te veroorzaken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

