
Wetenschap
Als het verschil 0,5 is in elektronegativiteitswaarden van twee atomen, bindt dan polair of niet -polair?
Dit is waarom:
* elektronegativiteit: Dit meet de neiging van een atoom om elektronen aan te trekken in een chemische binding.
* Polaire binding: Een polaire binding treedt op wanneer de elektronen in de binding niet gelijk worden gedeeld tussen de twee atomen. Dit gebeurt omdat het ene atoom een hogere elektronegativiteit heeft, de elektronen dichter bij zichzelf trekt en een gedeeltelijke negatieve lading (δ-) op dat atoom en een gedeeltelijke positieve lading (δ+) op het andere atoom creëert.
Hoewel een verschil van 0,5 als relatief klein wordt beschouwd, is het nog steeds voldoende om een lichte onbalans te creëren bij het delen van elektronen, wat resulteert in een polaire binding.
om u een algemeen idee te geven van obligatiepolariteit:
* 0.0 - 0.4: Niet -polaire covalente binding (elektronen bijna gelijk gedeeld)
* 0,5 - 1.7: Polaire covalente binding (elektronen ongelijk gedeeld)
* 1.7 en hoger: Ionische binding (elektronen in wezen overgebracht van het ene atoom naar het andere)
Vergeet niet dat dit slechts algemene richtlijnen zijn en er zijn altijd uitzonderingen. De exacte aard van de binding kan ook worden beïnvloed door factoren zoals de grootte van de atomen en het type molecuul.
 Hoe het probleem van klimaatverandering niet op te lossen
Hoe het probleem van klimaatverandering niet op te lossen Licht uit in Sydney voor behoudscampagne Earth Hour
Licht uit in Sydney voor behoudscampagne Earth Hour In de media-aandacht voor klimaatverandering, waar zijn de feiten?
In de media-aandacht voor klimaatverandering, waar zijn de feiten? Waarom plastic tassen zo moeilijk te verwijderen zijn
Waarom plastic tassen zo moeilijk te verwijderen zijn Waarom een invasieve rups zich een weg baant door boombladeren, tijdens de grootste uitbraakdecennia
Waarom een invasieve rups zich een weg baant door boombladeren, tijdens de grootste uitbraakdecennia
Hoofdlijnen
- Een doorbraak op het gebied van cellulaire engineering:high-yield CRISPR zonder virale vectoren
- Ethics of Genetic Engineering
- Geavanceerde microscopen helpen wetenschappers begrijpen hoe cellen eiwitten afbreken
- Wat is celcompartimentering en waarom gebeurt het?
- Hoe worden cellen in de epidermis vervangen?
- Wat is exoccomunicatie?
- Was RNA het oorspronkelijke prebiotische molecuul?
- Kunnen algen die 'arme leveranciers' zijn, koralen helpen terugkomen na het bleken?
- Burgerwetenschappers helpen bij het vastleggen van wilde zoogdieren op camera
- Onderzoekers ontwikkelen op smartphone gebaseerde ovulatietest
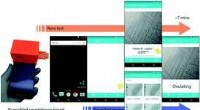
- Wetenschappers creëren op een eenvoudige manier onmogelijke materialen
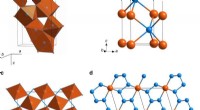
- Wetenschappers ontwikkelen een cellulose-biosensormateriaal voor geavanceerde weefseltechnologie
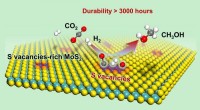
- Katalytische hydrogenering van kooldioxide tot methanol
- We hebben een microscoopglaasje gemaakt dat de diagnose van kanker zou kunnen verbeteren door de kleur van kankercellen te onthullen

 Texanen moedigden aan om de nachtelijke lichten uit te doen tijdens de vogeltrek
Texanen moedigden aan om de nachtelijke lichten uit te doen tijdens de vogeltrek  Cuba evacueert 180, 000 als tropische storm Elsa nadert
Cuba evacueert 180, 000 als tropische storm Elsa nadert De genetica van schijfziekte bij honden ontrafelen
De genetica van schijfziekte bij honden ontrafelen Hoe zou u kunnen vaststellen of er een anilinederivaattint in het haar zit?
Hoe zou u kunnen vaststellen of er een anilinederivaattint in het haar zit?  Is grondwater vaste vloeistof of gas?
Is grondwater vaste vloeistof of gas?  Wat geloven astronomen nu over het beïnvloeden van Uranus en Neptune -banen?
Wat geloven astronomen nu over het beïnvloeden van Uranus en Neptune -banen?  Afbeelding:Adamas Labyrinthus op Mars
Afbeelding:Adamas Labyrinthus op Mars Welk effect veroorzaakt de heersende wind diagonaal?
Welk effect veroorzaakt de heersende wind diagonaal?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

