
Wetenschap
Wat is een niet -polair aminozuur?
Hier is een uitsplitsing:
* aminozuren: De bouwstenen van eiwitten. Ze hebben allemaal een centraal koolstofatoom (alfa -koolstof) gebonden aan een aminogroep (NH2), een carboxylgroep (COOH), een waterstofatoom (H) en een zijketen (R -groep).
* zijketen (R-Group): Het deel van het aminozuur dat het zijn unieke eigenschappen geeft.
* niet-polair: Betekent dat de zijketen niet goed in wisselwerking staat met water. Dit komt omdat de zijketen bestaat uit koolwaterstoffen, die voornamelijk koolstof- en waterstofatomen zijn. Koolstof en waterstof hebben een vergelijkbare elektronegativiteit, wat betekent dat ze relatief gelijk elektronen delen. Dit resulteert in een molecuul dat niet polair is.
Voorbeelden van niet-polaire aminozuren:
* glycine (gly, g): Eenvoudigste aminozuur met alleen een waterstofatoom als zijketen.
* Alanine (Ala, A): Heeft een methylgroep (CH3) als zijketen.
* valine (val, v): Heeft een vertakte koolwaterstofketen.
* leucine (Leu, L): Vergelijkbaar met Valine maar met een extra koolstofatoom.
* isoleucine (ile, i): Nog een vertakte koolwaterstofketen.
* proline (pro, p): Unieke cyclische structuur.
* fenylalanine (Phe, F): Bevat een benzeenring.
* methionine (Met, M): Bevat een zwavelatoom.
* tryptophan (trp, w): Bevat een dubbele ringstructuur.
Belang van niet-polaire aminozuren:
* Eiwitvouwen: Niet-polaire aminozuren hebben de neiging om samen te clusteren in het interieur van eiwitten, weg van water. Deze hydrofobe interactie is een belangrijke drijvende kracht bij het vouwen van eiwitten.
* membraaneiwitten: Niet-polaire aminozuren worden vaak aangetroffen in transmembraangebieden van eiwitten, waardoor ze kunnen interageren met de hydrofobe omgeving van het celmembraan.
* functie: De hydrofobiciteit van niet-polaire aminozuren kan de functie van eiwitten beïnvloeden, zoals in enzymactiviteit of eiwit-eiwitinteracties.
Laat het me weten als je meer details wilt over een specifiek niet-polair aminozuur!
 Onderzoek om zich te concentreren op hoe herten reageren op veranderingen in de maanfase en het weer
Onderzoek om zich te concentreren op hoe herten reageren op veranderingen in de maanfase en het weer  Hypoxie is wijdverspreid en neemt toe in de oceaan voor de kust van de Stille Oceaan, zo blijkt uit onderzoek
Hypoxie is wijdverspreid en neemt toe in de oceaan voor de kust van de Stille Oceaan, zo blijkt uit onderzoek  Menselijke activiteit heeft het Murray-estuarium kwetsbaarder gemaakt voor droogte
Menselijke activiteit heeft het Murray-estuarium kwetsbaarder gemaakt voor droogte Geofysici ontdekken nieuw bewijs voor een alternatieve stijl van platentektoniek
Geofysici ontdekken nieuw bewijs voor een alternatieve stijl van platentektoniek Rapport toont aan dat klimaatverandering het Amerikaanse financiële systeem in gevaar brengt
Rapport toont aan dat klimaatverandering het Amerikaanse financiële systeem in gevaar brengt
Hoofdlijnen
- Waarom vriezen vissen niet dood in ijskoud water?
- Hoe komt het dat andere voedingsstoffen kunnen worden gemetaboliseerd om ATP op te leveren?
- Wat zijn de 4 kenmerken die biologen gebruiken om levende dingen te herkennen?
- Wat waakzame inktvissen ons kunnen leren over het doel van pijn
- Vijf belangrijke orgaansystemen van het lichaam
- Hoe onderzoekers de zaadproductie voor nieuwe tarwe versnellen
- Hoe een biologisch diagram te tekenen
- Wat is er anders tussen de twee soorten gisting?
- Onderzoekers ontdekken hoe vogelveren bestand zijn tegen scheuren
- Stoffen gezichtsmaskers die kunnen worden gedesinfecteerd door zonlicht

- Palladium, ontmoet koper:onderzoekers gebruiken machine learning om katalysatoren te verbeteren

- Wetenschappers gebruiken licht om vetzuren om te zetten in alkanen
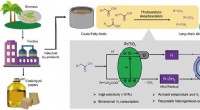
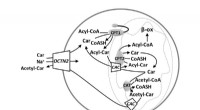
- OCTN:een transporter met relevantie voor menselijke pathofysiologie, ontdekking en diagnostiek van geneesmiddelen
- Unieke chemie - die ooit zou kunnen helpen bij het bestrijden van ernstige ziekten - gevonden in de Nieuw-Zeelandse glimworm

 Hoe helpt M -eiwit Streptococcus pyogenes fagocyten ontwijken?
Hoe helpt M -eiwit Streptococcus pyogenes fagocyten ontwijken?  Hoe een mRNA-sequentie
Hoe een mRNA-sequentie  Wanneer wordt een proto -ster ster?
Wanneer wordt een proto -ster ster?  The Distribution of Fossils and Plate Tectonics Theory
The Distribution of Fossils and Plate Tectonics Theory  Wat is de enige soort golf die geen vaste vloeistof of gasmedium nodig heeft om door te gaan?
Wat is de enige soort golf die geen vaste vloeistof of gasmedium nodig heeft om door te gaan?  Fords elektrische aandrijving vindt historische fabriek in Michigan opnieuw uit
Fords elektrische aandrijving vindt historische fabriek in Michigan opnieuw uit Atlanta voelt nog steeds de gevolgen van ransomware cyberaanval
Atlanta voelt nog steeds de gevolgen van ransomware cyberaanval Dieper onderzoek naar grafeen met behulp van regenboogverstrooiing
Dieper onderzoek naar grafeen met behulp van regenboogverstrooiing
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

