
Wetenschap
Welk element op het periodiek systeem heeft chemische eigenschappen die het meest lijken op die koolstof?
Dit is waarom:
* Dezelfde groep: Zowel koolstof als silicium behoren tot groep 14 (IVA) van het periodiek systeem. Elementen in dezelfde groep hebben vergelijkbare chemische eigenschappen als gevolg van hetzelfde aantal valentie -elektronen (elektronen in de buitenste schaal).
* valentie -elektronen: Zowel koolstof als silicium hebben vier valentie -elektronen, waardoor ze vier covalente bindingen kunnen vormen.
* Mogelijkheid om ketens en ringen te vormen: Beide elementen kunnen lange ketens en complexe ringstructuren vormen. Deze eigenschap is essentieel voor de vorming van grote en diverse moleculen, zoals die in organische chemie.
Er zijn echter enkele verschillen:
* elektronegativiteit: Koolstof is meer elektronegatief dan silicium, wat betekent dat het elektronen sterker aantrekt.
* bindingssterkte: Silicium-siliciumbindingen zijn zwakker dan koolstof-koolstofbindingen, waardoor siliciumverbindingen onder bepaalde omstandigheden minder stabiel zijn.
* Reactiviteit: Silicium is over het algemeen reactiever dan koolstof, vooral met zuurstof.
Samenvattend: Hoewel er verschillen zijn, maken de overeenkomsten in hun valentie -elektronenconfiguratie en bindingsmogelijkheden silicium het dichtstbijzijnde element tot koolstof in termen van chemisch gedrag.
 Wat zijn de drie mechanismen van verwijdering van waterstofionen?
Wat zijn de drie mechanismen van verwijdering van waterstofionen?  Katalytische reacties beheersen door nano-oppervlakken te veranderen
Katalytische reacties beheersen door nano-oppervlakken te veranderen Spectroscopische techniek waarbij watermoleculen die op het oppervlak liggen worden opgespoord, laat zien hoe ze ontspannen nadat ze zijn opgewonden
Spectroscopische techniek waarbij watermoleculen die op het oppervlak liggen worden opgespoord, laat zien hoe ze ontspannen nadat ze zijn opgewonden  Nieuwe wending in de race om de grafietanode te vervangen voor betere oplaadbare batterijen
Nieuwe wending in de race om de grafietanode te vervangen voor betere oplaadbare batterijen Wetenschappers rusten chemische sensoren uit met vallen om giftige stoffen te detecteren
Wetenschappers rusten chemische sensoren uit met vallen om giftige stoffen te detecteren
 Peru opent militaire basis om Amazone te beschermen tegen ontbossing
Peru opent militaire basis om Amazone te beschermen tegen ontbossing Veganistisch is het nieuwe vegetarisch - waarom supermarkten plantaardig moeten gaan om de planeet te redden
Veganistisch is het nieuwe vegetarisch - waarom supermarkten plantaardig moeten gaan om de planeet te redden Geografische landvormen in Texas
Geografische landvormen in Texas Weer en klimaat worden door elkaar gebruikt. Dat zouden ze niet moeten zijn
Weer en klimaat worden door elkaar gebruikt. Dat zouden ze niet moeten zijn De geologische geschiedenis van de aarde begrijpen om de toekomst te voorspellen
De geologische geschiedenis van de aarde begrijpen om de toekomst te voorspellen
Hoofdlijnen
- Welk lichaamsdeel is verbonden met de keelholte?
- Moleculaire markers onderzoeken de natuurlijke populatiestructuur en eigenschapgerelateerde loci van kiwibes
- Wat is de structuur en functie van ATP?
- Het nepnieuwsprobleem van Facebook:wat is de verantwoordelijkheid ervan?
- Nieuwe Japanse leliesoort geïdentificeerd, eerste toevoeging aan de sukashiyuri-groep in 110 jaar
- Welke vier conditie moeten bacteriën hebben om te fokken?
- Heb je katoen? De ontdekking van onderzoekers uit Texas zou eiwitten kunnen opleveren om miljoenen mensen te voeden
- Een fokprogramma voor natuurbehoud opzetten om de laatste saola te redden
- Het symposium in Pittsburgh antwoordt:Wat is Watson?
- Onderzoekers vinden potentiële nieuwe bron van zeldzame aardelementen

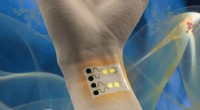
- Een draagbare gassensor voor gezondheids- en milieumonitoring
- Wetenschappers ontdekken het mechanisme van luminescentie van schimmels en creëren luminescente gisten

- Een lichtgewicht op koolstof nanovezel gebaseerde collector
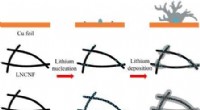
- Verdwijningshandeling:apparaat verdwijnt op commando na militaire missies

 Hoe op jacht te gaan naar exoplaneten
Hoe op jacht te gaan naar exoplaneten  Ingenieurs 3D-print vormveranderende slimme gel
Ingenieurs 3D-print vormveranderende slimme gel Wat is de directeur van flagellaire kleuring?
Wat is de directeur van flagellaire kleuring?  Kunststoffen, afval en recycling:het is niet alleen een verpakkingsprobleem
Kunststoffen, afval en recycling:het is niet alleen een verpakkingsprobleem NASA onderzoekt tropische storm Uesis zware regenval
NASA onderzoekt tropische storm Uesis zware regenval Studie benadrukt het potentieel van digitale elektronica met nanobuisjes
Studie benadrukt het potentieel van digitale elektronica met nanobuisjes Facebook verbiedt door het buitenland gefinancierde advertenties voor verkiezingen in Indonesië
Facebook verbiedt door het buitenland gefinancierde advertenties voor verkiezingen in Indonesië Pandemische drones:handig voor het afdwingen van sociale afstand, of voor het creëren van een politiestaat?
Pandemische drones:handig voor het afdwingen van sociale afstand, of voor het creëren van een politiestaat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

