
Wetenschap
Hoe scheid je waterstof en zuurstofgas nadat je het van elektrolyse hebt gemaakt?
1. Elektrolyse -opstelling
* elektrolyt: Gebruik een oplossing zoals verdunde zwavelzuur (H₂so₄) of kaliumhydroxide (KOH) als de elektrolyt.
* elektroden: Gebruik inerte elektroden zoals platina of grafiet.
* Verzameling buizen: Twee afzonderlijke testbuizen of afgestudeerde cilinders, gevuld met de elektrolyt, zijn omgekeerd over de elektroden.
2. Het proces
* elektrolyse: Wanneer een elektrische stroom door de elektrolyt wordt geleid, worden watermoleculen opgesplitst in waterstof- en zuurstofgas:
* bij de kathode (negatieve elektrode): 2h⁺ + 2e⁻ → H₂ (waterstofgas wordt geproduceerd)
* bij de anode (positieve elektrode): 2h₂o → o₂ + 4h⁺ + 4e⁻ (zuurstofgas wordt geproduceerd)
* Gasverzameling: Waterstofgas wordt verzameld bij de kathode en zuurstofgas wordt verzameld bij de anode.
3. Scheiding
* opwaartse verplaatsing: De gassen worden verzameld door opwaartse verplaatsing van de elektrolyt in de omgekeerde buizen. Dit komt omdat waterstof en zuurstof minder dicht zijn dan water.
* scheiding door volume: Het volume verzamelde waterstofgas is tweemaal het volume verzamelde zuurstofgas (vanwege de chemische vergelijking voor elektrolyse).
belangrijke overwegingen
* Veiligheid: Elektrolyse produceert brandbaar waterstofgas. Doe dit experiment alleen in een goed geventileerd gebied en met passende veiligheidsmaatregelen.
* zuiverheid: De verzamelde gassen kunnen sporen van de elektrolyt bevatten. Als een hoge zuiverheid vereist is, kunnen verdere zuiveringsstappen nodig zijn.
Samenvatting
De scheiding van waterstof- en zuurstofgas na elektrolyse is gebaseerd op het feit dat deze gassen worden geproduceerd bij verschillende elektroden en verschillende dichtheden hebben. Het proces omvat het verzamelen van de gassen door opwaartse verplaatsing en ze vervolgens scheiden op basis van hun volumeverhouding.
 Waarom bewegen deeltjes vrijer in een gas dan in vloeistof?
Waarom bewegen deeltjes vrijer in een gas dan in vloeistof?  Synthetische moleculen leveren medicijnen rechtstreeks aan neuroblastoomcellen
Synthetische moleculen leveren medicijnen rechtstreeks aan neuroblastoomcellen Verbinding gevormd tussen ammonium en fosfaation is?
Verbinding gevormd tussen ammonium en fosfaation is?  Membranen voor het op industriële schaal scheiden van chemische mengsels
Membranen voor het op industriële schaal scheiden van chemische mengsels Waarom wordt stikstof gebruikt als desinfectiemiddel?
Waarom wordt stikstof gebruikt als desinfectiemiddel?
 Zijn klimaatwetenschappers te voorzichtig bij het koppelen van extreem weer aan klimaatverandering?
Zijn klimaatwetenschappers te voorzichtig bij het koppelen van extreem weer aan klimaatverandering? Tropische cyclonen kunnen de gezondheid van mangroves verbeteren
Tropische cyclonen kunnen de gezondheid van mangroves verbeteren Wetenschappers dringen aan op voorzichtigheid, verdere beoordeling van ecologische effecten boven diepzeemijnbouw
Wetenschappers dringen aan op voorzichtigheid, verdere beoordeling van ecologische effecten boven diepzeemijnbouw Stijgende zeespiegels en toenemende stormen vormen een bedreiging voor kustgemeenschappen
Stijgende zeespiegels en toenemende stormen vormen een bedreiging voor kustgemeenschappen Waarom zijn ondiepe meren gevoelig voor eutrofiëring?
Waarom zijn ondiepe meren gevoelig voor eutrofiëring?
Hoofdlijnen
- Onderzoekers laten zien hoe opportunistische bacteriën concurrenten verslaan
- Wie zijn de Filipijnse wetenschapper en hun kenmerken?
- Alternatieve evolutie:waarom je eigen genen veranderen als je die van iemand anders kunt lenen?
- Hoe beïnvloedt de pH de werking van enzymen?
- Chimpansees bleken arm- en monduitdrukkingen te gebruiken om afstand over te brengen
- Wat voor soort voeding wordt uitgevoerd door schimmel?
- Welke chemische stof wordt soms gebruikt om cellulair plastic te maken?
- Wat is een antoniem van eiwitten?
- Projectideeën om het menselijk spijsverteringssysteem op de middelbare school voor studenten te laten zien
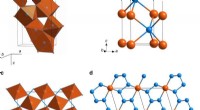
- Beheersbare oppervlaktedefect engineering op overgangsmetaal trichalcogenide
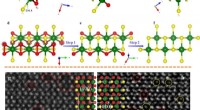
- Wetenschappers creëren op een eenvoudige manier onmogelijke materialen
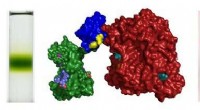
- Team ontwikkelt fotosynthetische eiwitten voor uitgebreide omzetting van zonne-energie
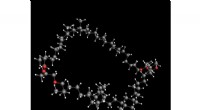
- Synthese van een van de meest voorkomende organische lipiden verheldert de structuur ervan
- De scheikundige laat zien dat intermoleculaire interacties voorheen onbekende dimensies kunnen bereiken

 Sugar-inhoud meten met een laseraanwijzer
Sugar-inhoud meten met een laseraanwijzer  Welke energie is de totale hoeveelheid kinetische en potentiële energie?
Welke energie is de totale hoeveelheid kinetische en potentiële energie?  Hoe echografie werkt
Hoe echografie werkt  Antartica, hart van de aarde heeft bescherming nodig:expert
Antartica, hart van de aarde heeft bescherming nodig:expert Is het mengen van zink en zwavel bij kamertemperatuur een chemische verandering bij kamertemperatuur?
Is het mengen van zink en zwavel bij kamertemperatuur een chemische verandering bij kamertemperatuur?  TikTok voegt authenticiteitsfunctie toe die BeReal weerspiegelt
TikTok voegt authenticiteitsfunctie toe die BeReal weerspiegelt Wat betekent rol in wetenschapstermen?
Wat betekent rol in wetenschapstermen?  Wat is het stedelijk hitte-eilandeffect?
Wat is het stedelijk hitte-eilandeffect?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

