
Wetenschap
Waarom bewegen deeltjes vrijer in een gas dan in vloeistof?
Het verschil in deeltjesbeweging tussen vloeistoffen en gassen is te wijten aan het verschil in hun moleculaire structuren. Vloeistoffen zijn samengesteld uit moleculen die dicht bij elkaar zijn gepakt, terwijl gassen zijn samengesteld uit moleculen die ver uit elkaar liggen. De nabijheid van de moleculen in een vloeistof creëert sterke cohesiekrachten daartussen, terwijl de grote afstand tussen de moleculen in een gas zwakke cohesiekrachten creëert.
De sterkte van de cohesiekrachten in een vloeistof wordt ook beïnvloed door de temperatuur van de vloeistof. Naarmate de temperatuur van een vloeistof stijgt, neemt ook de gemiddelde kinetische energie van de vloeistofdeeltjes toe. Deze toename van de kinetische energie zorgt ervoor dat de vloeibare deeltjes sneller en willekeuriger bewegen, wat de cohesiekrachten ertussen verzwakt. Als gevolg hiervan wordt een vloeistof minder stroperig en meer op een gas naarmate de temperatuur stijgt.
Samenvattend bewegen de deeltjes in een gas vrijer dan de deeltjes in een vloeistof vanwege de zwakkere cohesiekrachten tussen de deeltjes in een gas. De zwakkere cohesiekrachten in een gas zijn te wijten aan de grote afstand tussen de moleculen in een gas vergeleken met de nabijheid van de moleculen in een vloeistof.
 Marshalleilanden overwegen radicale maatregelen om stijgende zeespiegel te overleven
Marshalleilanden overwegen radicale maatregelen om stijgende zeespiegel te overleven IJsscheuren dwingen sluiting van Brits Antarctisch station af (update)
IJsscheuren dwingen sluiting van Brits Antarctisch station af (update) Wil je weten wat oude koala's aten? Controleer de tanden van moderne koala's
Wil je weten wat oude koala's aten? Controleer de tanden van moderne koala's  Hoe overheden en bedrijven naar de mensen moeten luisteren als het om klimaatverandering gaat
Hoe overheden en bedrijven naar de mensen moeten luisteren als het om klimaatverandering gaat  Zeehondengedrag om te informeren over zeespiegelstijging
Zeehondengedrag om te informeren over zeespiegelstijging
Hoofdlijnen
- Hoe transcriptie epigenetische silencing oplevert
- Onderzoekers trainen een reeks AI-modellen om signalen voor geheugenvorming in de hersenen te identificeren
- Studie verklaart regionale verschillen in vogeldiversiteit in agroforestry-systemen
- Hoe kan een fout tijdens de transcriptie het geproduceerde eiwit beïnvloeden?
- Opnieuw geïntroduceerde buideldieren kunnen een nieuwe bedreiging vormen voor op de grond levende vogels
- Wat is de rol van mRNA bij de eiwitsynthese?
- Wat we leren van een vis die in slechts 10 dagen van geslacht kan veranderen
- Wat concludeerde Thomas Hunt Morgan over de chromosomen van de fruitvlieg?
- Evenwichtige bemesting:een steunpunt voor duurzame productie van maïs en rijst in Afrika
- Bacteriën gebruiken om CO2-afvang in oceanen te versnellen

- Een methode om kristallen te construeren met een grote fractie reactieve facetten

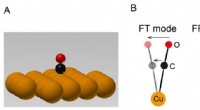
- Opheldering van trillingsenergie van een enkel molecuul in een extern krachtveld
- Metaalademende bacteriën kunnen elektronica transformeren, biosensoren, en meer

- Speciale warmtebehandeling verbetert nieuw magnetisch materiaal
 Wat octopus en menselijke hersenen gemeen hebben
Wat octopus en menselijke hersenen gemeen hebben  Scott Pruitts benadering van vervuilingsbeheersing zal de lucht vuiler maken en Amerikanen minder gezond
Scott Pruitts benadering van vervuilingsbeheersing zal de lucht vuiler maken en Amerikanen minder gezond Studie onthult dat leven in het universum heel gewoon kan zijn, maar niet in onze buurt
Studie onthult dat leven in het universum heel gewoon kan zijn, maar niet in onze buurt Nieuwe ontdekking duwt oorsprong van veren 70 miljoen jaar terug
Nieuwe ontdekking duwt oorsprong van veren 70 miljoen jaar terug Nieuwe methaanconcentratietechnologieën voor monitoring van broeikasgasemissies
Nieuwe methaanconcentratietechnologieën voor monitoring van broeikasgasemissies Bosbranden woeden in Griekenland, de geboorteplaats van de Olympische Spelen bedreigen
Bosbranden woeden in Griekenland, de geboorteplaats van de Olympische Spelen bedreigen Light frisdrank en friet, alstublieft:hoe consumenten hun voedselkeuzes in evenwicht brengen
Light frisdrank en friet, alstublieft:hoe consumenten hun voedselkeuzes in evenwicht brengen  VS in diepvries, terwijl een groot deel van de wereld extra lekker warm is? Nogmaals, het is klimaatverandering
VS in diepvries, terwijl een groot deel van de wereld extra lekker warm is? Nogmaals, het is klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

