
Wetenschap
Wat gebeurt er fysiek als water een stof oplossen?
1. Polariteit en aantrekkingskracht
* Water is een polair molecuul: Het zuurstofatoom heeft een enigszins negatieve lading en de waterstofatomen hebben enigszins positieve ladingen. Dit creëert een dipoolmoment in het watermolecuul.
* opgeloste stoffen kunnen polair of niet-polair zijn:
* Polaire opgeloste stoffen: Een ongelijke verdeling van elektronen hebben, waardoor gedeeltelijke positieve en negatieve ladingen ontstaan. Denk aan tafelzout (NaCl), waarbij het natrium (NA) positief geladen is en chloor (CL) negatief is geladen.
* Niet-polaire opgeloste stoffen: Hebben een gelijkmatige verdeling van elektronen, wat betekent dat geen significante scheiding van ladingen. Denk aan olie of vetten.
* "zoals oplost zoals": Polaire stoffen lossen goed op in polaire oplosmiddelen (zoals water), terwijl niet-polaire stoffen goed oplossen in niet-polaire oplosmiddelen (zoals olie). Dit komt omdat de aantrekkelijke krachten tussen de moleculen van de opgeloste stof en oplosmiddel sterker zijn dan de krachten die de opgeloste moleculen bij elkaar houden.
2. Het oplossingsproces
* rond de opgeloste stof: Wanneer een polaire opgeloste stof zoals zout (NaCl) wordt toegevoegd aan water, omringen de watermoleculen de afzonderlijke zoutionen (Na+ en Cl-). De negatieve uiteinden van de watermoleculen (zuurstof) oriënteren zich op de positief geladen natriumionen, en de positieve uiteinden van de watermoleculen (waterstof) oriënteren zich op de negatief geladen chloride -ionen.
* de opgeloste stof afbreken: Deze interactie creëert een sterke aantrekkingskracht tussen de watermoleculen en de ionen, waardoor ze effectief uit het zoutkristal worden getrokken.
* Hydratatieschelp: De watermoleculen rond de ionen vormen een hydratatieschaal, waardoor de ionen gescheiden en opgelost houden in de oplossing.
3. Factoren die de oplosbaarheid beïnvloeden
* Temperatuur: Over het algemeen verhoogt het verhogen van de temperatuur de oplosbaarheid omdat de moleculen meer energie hebben om aantrekkelijke krachten te overwinnen.
* Druk: Druk heeft een groter effect op de oplosbaarheid van gassen. Hogere druk dwingt meer gasmoleculen in oplossing.
* polariteit: Zoals eerder vermeld, speelt de polariteit van zowel de opgeloste stof als het oplosmiddel een cruciale rol bij het bepalen van de oplosbaarheid.
Belangrijke opmerking:
* Niet alle stoffen lossen op in water. Sommige stoffen, zoals zand of olie, zijn niet erg oplosbaar in water omdat de krachten tussen hun moleculen sterker zijn dan de aantrekkingskracht op watermoleculen.
Laat het me weten als je een meer gedetailleerde uitleg van een van deze punten wilt!
 Welke menselijke activiteiten hebben een negatief effect op de oceaan?
Welke menselijke activiteiten hebben een negatief effect op de oceaan?  Door te achterhalen hoe het leven op aarde is ontstaan, kan dit helpen verduidelijken waar het nog meer zou kunnen bestaan
Door te achterhalen hoe het leven op aarde is ontstaan, kan dit helpen verduidelijken waar het nog meer zou kunnen bestaan  Australië schrapt wetsvoorstel klimaatdoelen na aftreden premier
Australië schrapt wetsvoorstel klimaatdoelen na aftreden premier Wat zijn de zes brede typen van klimaatregio's?
Wat zijn de zes brede typen van klimaatregio's?  Beheersing van antropogene emissies kan de waterkwaliteit in kustzeeën verbeteren
Beheersing van antropogene emissies kan de waterkwaliteit in kustzeeën verbeteren
Hoofdlijnen
- Zijn mannelijke Y-chromosomen korter dan X-chromosomen?
- Onderzoekers vinden dat diffusie een ongebruikelijke signaalrol speelt in Drosophila-embryo's
- Poema's die in de buurt van menselijke ontwikkeling leven, verbruiken meer energie
- Hoe ongewenste componenten uit de celkern te verwijderen
- Genetische ontdekking helpt Angus-producenten hun kuddes te beschermen
- Hoe maken aminozuren eiwitten?
- Ontdekking vergroot het begrip hoe bacteriën zich verspreiden
- Wat zijn de drie belangrijkste wetenschapsgroepen?
- Wat is een biofilm?
- Onderzoek naar roamingreacties om nieuw licht te werpen op atmosferische moleculen

- Creatie en selectieve functionalisering van virusachtige polymeerdeeltjes
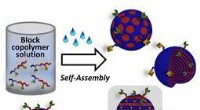
- Met behulp van twee CRISPR-enzymen, een COVID-diagnose in slechts 20 minuten

- Katalysator maakt reacties mogelijk met behulp van groen licht

- Nieuwe ontdekking in exoskeletten van dieren leidt tot vooruitgang in het ontwerpen van bouwmaterialen
 Welk Zuid -Amerikaanse land ligt het dichtst bij de evenaar?
Welk Zuid -Amerikaanse land ligt het dichtst bij de evenaar?  Hoe een fractie in tweeën te verdelen
Hoe een fractie in tweeën te verdelen Wie heeft de eerste nebula gevonden?
Wie heeft de eerste nebula gevonden?  Baanbrekend onderzoek leidt tot detectie van kleinste virusdeeltje, implicaties voor vroege behandeling van ziekte
Baanbrekend onderzoek leidt tot detectie van kleinste virusdeeltje, implicaties voor vroege behandeling van ziekte Final Year Projects for Electrical Students
Final Year Projects for Electrical Students Eco-lijm kan schadelijke lijmen in houtconstructies vervangen
Eco-lijm kan schadelijke lijmen in houtconstructies vervangen SpaceX Starhopper beschadigd bij harde wind
SpaceX Starhopper beschadigd bij harde wind Wat is Santorini vulkanoshoogte?
Wat is Santorini vulkanoshoogte?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

