
Wetenschap
Katalysator maakt reacties mogelijk met behulp van groen licht

Kolven die de titaniumkatalysator en de rode kleurstof bevatten, die worden bestraald met groen licht in het laboratorium van het Kekulé Instituut voor Organische Chemie en Biochemie aan de Universiteit van Bonn. Krediet:Zhenhua Zhang
Voor de eerste keer, chemici van de Universiteit van Bonn en Lehigh University in de VS hebben een titaniumkatalysator ontwikkeld die licht bruikbaar maakt voor selectieve chemische reacties. Het biedt een kosteneffectief en niet-toxisch alternatief voor de momenteel gebruikte ruthenium- en iridiumkatalysatoren, die zijn gebaseerd op zeer dure en giftige metalen. De nieuwe katalysator kan worden gebruikt om zeer selectieve chemische producten te produceren die de basis kunnen vormen voor antivirale geneesmiddelen of lichtgevende kleurstoffen, bijvoorbeeld. De resultaten zijn gepubliceerd in de internationale editie van het tijdschrift Angewandte Chemie .
Elektronen in chemische moleculen zijn terughoudend om een enkel leven te leiden; ze komen meestal in paren voor. Dan zijn ze bijzonder stabiel en hebben ze niet de neiging om nieuwe partnerships aan te gaan in de vorm van nieuwe banden. Echter, als een deel van de elektronen met behulp van licht (fotonen) op een hoger energieniveau wordt gebracht, dingen beginnen er anders uit te zien als het gaat om deze "monogamie":in zo'n opgewonden toestand, de moleculen willen graag een elektron doneren of accepteren. Hierdoor ontstaan zogenaamde 'radicalen, ' die elektronen hebben, zijn zeer reactief en kunnen worden gebruikt om nieuwe bindingen te vormen.
Bestraling met groen licht
Deze nieuwe katalysator is gebaseerd op dit principe:de kern is titanium, die is verbonden met een koolstofring waarin de elektronen bijzonder mobiel zijn en gemakkelijk kunnen worden geëxciteerd. Groen licht is voldoende om de katalysator voor elektronenoverdracht te gebruiken om reactieve organische tussenproducten te produceren die anders niet gemakkelijk verkrijgbaar zijn. "In het laboratorium, we bestraalden een reactiekolf met daarin de titaankatalysator die met groen licht kan worden gezien als een 'rode kleurstof', " meldt Prof. Dr. Andreas Gansäuer van het Kekulé Instituut voor Organische Chemie en Biochemie aan de Universiteit van Bonn. "En het werkte meteen." Het mengsel genereert radicalen van organische moleculen die vele reactiecycli initiëren waaruit een grote verscheidenheid aan chemische producten kunnen worden geproduceerd.
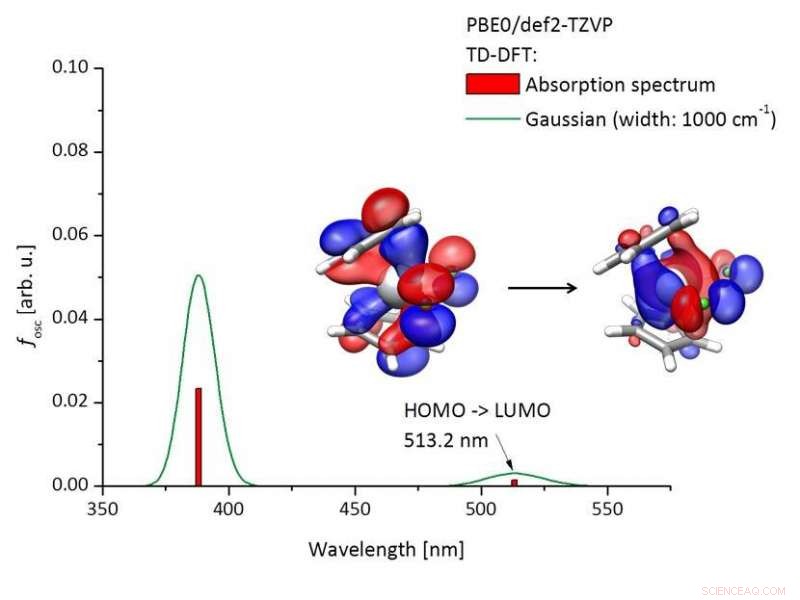
Berekend absorptiespectrum van Titanocendichlorid [(C5H4)2TiCl2)] en moleculaire orbitalen die betrokken zijn bij de excitatie. Krediet:Tobias Hilche
Een sleutelfactor bij reacties met deze foto-redoxkatalysator is de golflengte van het licht dat voor bestraling wordt gebruikt. "Ultraviolette straling is ongeschikt omdat het veel te energierijk is en de organische verbindingen zou vernietigen, ", zegt Gansäuer. Groen licht van LED-lampen is zowel mild als energierijk genoeg om de reactie op gang te brengen.
Katalysatoren zijn stoffen die de snelheid van chemische reacties verhogen en de activeringsenergie verlagen zonder zelf verbruikt te worden. Dit betekent dat ze continu beschikbaar zijn en reacties kunnen veroorzaken die anders niet in deze vorm zouden optreden. Afhankelijk van het organische molecuul waarmee het titaan is gebonden, kan de katalysator op de gewenste producten worden afgestemd.
Bouwstenen voor antivirale middelen of lichtgevende kleurstoffen
De nieuwe titaniumkatalysator vergemakkelijkt de reacties van epoxiden, een groep chemicaliën waaruit epoxyhars wordt gemaakt. Deze worden gebruikt als lijm of voor composieten. Echter, de wetenschappers mikken niet op dit massaproduct, maar voor de synthese van veel waardevollere fijnchemicaliën. "De op titanium gebaseerde, op maat gemaakte foto-redoxkatalysatoren kunnen bijvoorbeeld worden gebruikt om bouwstenen te produceren voor antivirale geneesmiddelen of luminescente kleurstoffen, ", zegt Gansäuer. Hij is ervan overtuigd dat deze nieuwe katalysatoren een kosteneffectief en duurzamer alternatief bieden voor de tot nu toe gebruikte ruthenium- en iridiumkatalysatoren, die zijn gebaseerd op zeer dure en giftige metalen.
De ontwikkeling is een internationale samenwerking van Zhenhua Zhang, Tobias Hilche, Daniël Slak, Niels Rietdijk en Andreas Gansäuer van de Universiteit van Bonn en Ugochinyere N. Oloyede en Robert A. Flowers II van Lehigh University (VS). Terwijl de wetenschappers van de Universiteit van Bonn onderzochten hoe de gewenste verbindingen het beste konden worden gesynthetiseerd met de nieuwe katalysator, hun collega's uit de VS voerden metingen uit om de reactieroutes te bewijzen. "Het luminescentie-fenomeen opent echt interessante ruimte om het ontwerp van nieuwe duurzame reacties te overwegen die verlopen via tussenproducten van vrije radicalen, " zegt prof. Robert Flowers van de Lehigh University.
 Een slimme chemo-enzymatische methode detecteert en verwijdert gevaarlijke fenolen
Een slimme chemo-enzymatische methode detecteert en verwijdert gevaarlijke fenolen Video:Kan er leven zijn zonder koolstof?
Video:Kan er leven zijn zonder koolstof? Hoe men één deeloplossing mengt met vier delen water
Hoe men één deeloplossing mengt met vier delen water  3D-katalysatoren voor verbeterde hydrazinevrije drijfgassen
3D-katalysatoren voor verbeterde hydrazinevrije drijfgassen Machine learning kraakt de oxidatietoestanden van kristalstructuren
Machine learning kraakt de oxidatietoestanden van kristalstructuren
Hoofdlijnen
- Onderzoekers onthullen hoe stamcellen beslissingen nemen
- Hoe zal klimaatverandering de arctische kariboes en rendieren beïnvloeden?
- Een model waarmee planten hun fotosynthetische stofwisseling aanpassen aan de lichtintensiteit
- Depolarisatie en herpolarisatie van het celmembraan
- Seizoensgebonden afbeeldingen onthullen de wetenschap achter stamcellen
- Nieuwe benadering van onderzoek naar vogelnavigatie leidt tot ontwikkeling van besluitvormingsmodel voor dieren
- Commensalisme: definitie, types, feiten en voorbeelden
- De locatie van Cilia en Flagella
- Waar vindt ademhaling plaats?
- Chemici leiden de juiste structuur af van de A- en B-baulamycinen
- Baanbrekende studie van celsignalering belooft veel voor immuunonderzoek en daarbuiten
- Waarom beïnvloedt suiker het vriespunt van water?

- Studie toont potentieel voor milieuvriendelijke vervanging van plastic

- Flexibele elektronische huid helpt mens-machine-interacties

 Hoe Tienden van een Pond wordt geconverteerd naar Ounces
Hoe Tienden van een Pond wordt geconverteerd naar Ounces Nieuwe simulaties kunnen helpen bij de jacht op massale fusies van neutronensterren, zwarte gaten
Nieuwe simulaties kunnen helpen bij de jacht op massale fusies van neutronensterren, zwarte gaten Wetenschappers fabriceren nieuwe ternaire keramische fosfor voor warmwitte LED's
Wetenschappers fabriceren nieuwe ternaire keramische fosfor voor warmwitte LED's Geen zorgen, ga je vlucht halen, een robot parkeert je auto
Geen zorgen, ga je vlucht halen, een robot parkeert je auto Wetenschapper in het centrum van Facebook-gegevensschandaal wordt geconfronteerd met parlementsleden
Wetenschapper in het centrum van Facebook-gegevensschandaal wordt geconfronteerd met parlementsleden De volledig koolstof-nanobuis-transistor kan worden verfrommeld als een stuk papier
De volledig koolstof-nanobuis-transistor kan worden verfrommeld als een stuk papier Kooldioxide uit Silicon Valley beïnvloedt de chemie van Monterey Bay
Kooldioxide uit Silicon Valley beïnvloedt de chemie van Monterey Bay Prestatievezel met van kleur veranderende coating maakt mechanische belasting zichtbaar
Prestatievezel met van kleur veranderende coating maakt mechanische belasting zichtbaar
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

