
Wetenschap
De atomaire massa van een atoom is gebaseerd op een vergelijking met de zwavel-32?
Dat klopt niet helemaal! De atomaire massa van een atoom is gebaseerd op een vergelijking met carbon-12 , niet zwavel-32.
Dit is waarom:
* Carbon-12 is de standaard: Carbon-12 wordt gedefinieerd als een atoommassa van exact 12 atomaire massa-eenheden (AMU). Dit betekent dat één AMU gelijk is aan 1/12 de massa van een koolstof-12-atoom.
* Relatieve vergelijkingen: De atomaire massa's van alle andere elementen worden bepaald ten opzichte van koolstof-12. Als een atoom van element X bijvoorbeeld twee keer zo zwaar is als een carbon-12-atoom, zou de atoommassa ervan 24 AMU zijn.
Hoewel zwavel-32 in het verleden als standaard werd gebruikt, is het niet langer het geval. Carbon-12 werd de geaccepteerde standaard voor atomaire massa in de jaren zestig.
 Natuurkundigen tonen de ware strepen van drielaags metaaloxide
Natuurkundigen tonen de ware strepen van drielaags metaaloxide  Welk mengselstoffen worden uniform verdeeld over de en niet vrij gemakkelijk te onderscheiden van elkaar?
Welk mengselstoffen worden uniform verdeeld over de en niet vrij gemakkelijk te onderscheiden van elkaar?  Hoe T-vormige clusters de scheiding van lanthaniden bevorderen tijdens vloeistof-vloeistofextractie
Hoe T-vormige clusters de scheiding van lanthaniden bevorderen tijdens vloeistof-vloeistofextractie  Wat een molecuul met elektrisch laadgebieden wordt een genoemd?
Wat een molecuul met elektrisch laadgebieden wordt een genoemd?  Wanneer bij Atom wordt opgeladen, wordt het een ion genoemd, hoeveel elektronen zijn er in O2-?
Wanneer bij Atom wordt opgeladen, wordt het een ion genoemd, hoeveel elektronen zijn er in O2-?
 Is algen een decomposer, een aaseter of een producent?
Is algen een decomposer, een aaseter of een producent?  Mariene ecosystemen zijn bestand tegen klimaatverstoring
Mariene ecosystemen zijn bestand tegen klimaatverstoring We moeten de bescherming van het milieu versterken tijdens droogte - of we worden geconfronteerd met onomkeerbaar verlies
We moeten de bescherming van het milieu versterken tijdens droogte - of we worden geconfronteerd met onomkeerbaar verlies Hoe kan lokaal beleid bijdragen aan wereldwijde duurzaamheidsdoelen?
Hoe kan lokaal beleid bijdragen aan wereldwijde duurzaamheidsdoelen? GPM vindt dat de regenval afneemt in extra-tropische storm Gabrielle
GPM vindt dat de regenval afneemt in extra-tropische storm Gabrielle
Hoofdlijnen
- Wat bevat eiwitten?
- Hersenen hoe je werkt
- Unieke manieren om een DNA-model te bouwen
- Waar krijgen planten glucose en zuurstof nodig voor ademhaling?
- Hoe worden de Hallow -gebieden in de hersenen genoemd?
- Eenvoudige methode meet hoe lang bacteriën kunnen wachten op antibiotica
- De symbolische aap? Door tokens gemedieerde economische keuzes in getufte kapucijnen
- Waar kwam het leven vandaan?
- Wat was er eerst:twee- of driecellig stuifmeel? Nieuw onderzoek actualiseert een klassiek debat
- Computerprogramma kan een 2D-tekening in vrije vorm vertalen naar een DNA-structuur
- Ingenieurs maken slimme aerogel die lucht in drinkwater verandert

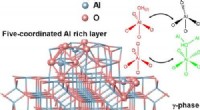
- Aard van vijf-gecoördineerd aluminium op γ-Al2O3-oppervlak
- Wat hangt er in de lucht? Er komt meer bij kijken dan we dachten
- Wetenschappers ontwikkelen een goedkopere methode die kan helpen bij het maken van brandstoffen uit planten

 Waarom heeft het aërobe metabolisme een voordeel ten opzichte van het anaërobe metabolisme bij levende wezens?
Waarom heeft het aërobe metabolisme een voordeel ten opzichte van het anaërobe metabolisme bij levende wezens?  Life Support handsfree installeren
Life Support handsfree installeren De ongelijke resultaten van anticorruptie-inspanningen tussen landen
De ongelijke resultaten van anticorruptie-inspanningen tussen landen  Hoe verschillen virussen van cellen in organellen?
Hoe verschillen virussen van cellen in organellen?  De naamgeving van Tooley-krater
De naamgeving van Tooley-krater Waarom werd Hercules een sterrenbeeld?
Waarom werd Hercules een sterrenbeeld?  NASA nachtelijke beelden vinden tropische storm Laura in ontwikkeling
NASA nachtelijke beelden vinden tropische storm Laura in ontwikkeling Katachtig gehoor met apparaat dat tientallen biljoenen keer kleiner is dan het menselijk trommelvlies
Katachtig gehoor met apparaat dat tientallen biljoenen keer kleiner is dan het menselijk trommelvlies
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

