
Wetenschap
Met behulp van twee CRISPR-enzymen, een COVID-diagnose in slechts 20 minuten
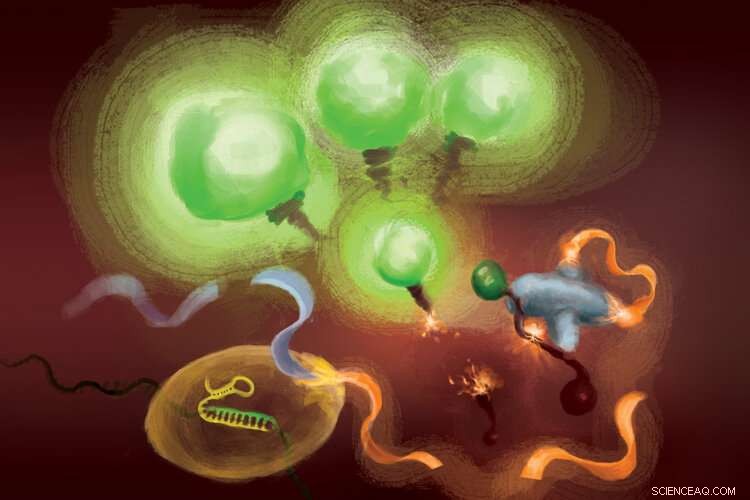
De reacties die betrokken zijn bij de FIND-IT-test om infectie met het SARS-CoV-2-virus te detecteren. Wanneer het Cas13-enzym (linksonder) bindt aan zijn doel-RNA, het knipt een molecuul (oranje en lichtblauw lint) om een activator (oranje) vrij te geven die het Csm6-nuclease (rechts) superchargeert om fluorescerende moleculen te splitsen en vrij te geven die oplichten (groen) en de aanwezigheid van viraal RNA signaleren. Krediet:Margaret L. Liu, Universiteit van Chicago Pritzker School of Medicine.
Veel voorkomend, snel testen op COVID-19 is van cruciaal belang voor het beheersen van de verspreiding van uitbraken, vooral als nieuw, meer overdraagbare varianten ontstaan.
Terwijl de huidige gouden standaard COVID-19 diagnostische test, die qRT-PCR gebruikt - kwantitatieve reverse-transcriptase-polymerase kettingreactie (PCR) - is extreem gevoelig, detecteren tot één kopie van RNA per microliter, het vereist gespecialiseerde apparatuur, een looptijd van enkele uren en een gecentraliseerde laboratoriumfaciliteit. Als resultaat, testen duurt meestal minstens één tot twee dagen.
Een onderzoeksteam onder leiding van wetenschappers in de laboratoria van Jennifer Doudna, David Savage en Patrick Hsu aan de Universiteit van Californië, Berkeley, streeft naar het ontwikkelen van een diagnostische test die veel sneller en gemakkelijker in te zetten is dan qRT-PCR. Het heeft nu twee verschillende soorten CRISPR-enzymen gecombineerd om een test te creëren die kleine hoeveelheden viraal RNA in minder dan een uur kan detecteren. Doudna deelde de Nobelprijs voor Scheikunde 2020 voor de uitvinding van CRISPR-Cas9-genoombewerking.
Hoewel de nieuwe techniek zich nog niet in het stadium bevindt waarin deze de gevoeligheid van qRT-PCR evenaart, die slechts een paar exemplaren van het virus per microliter vloeistof kan detecteren, het is al in staat om niveaus van viraal RNA op te pikken - ongeveer 30 kopieën per microliter - voldoende om te worden gebruikt om de bevolking te surveilleren en de verspreiding van infecties te beperken.
"Je hebt de gevoeligheid van PCR niet nodig om COVID-19 in de gemeenschap op te vangen en te diagnosticeren, als de test handig genoeg en snel genoeg is, " zei co-auteur David Savage, hoogleraar moleculaire en celbiologie. "Onze hoop was om de biochemie zo ver mogelijk te brengen dat je je een heel handig formaat zou kunnen voorstellen in een omgeving waar je elke dag getest kunt worden, zeggen, bij de ingang van het werk."
De onderzoekers zullen hun resultaten op 5 augustus online rapporteren in het tijdschrift Natuur Chemische Biologie .
Verschillende op CRISPR gebaseerde testen zijn goedgekeurd voor gebruik in noodgevallen door de Food and Drug Administration, maar ze vereisen allemaal een eerste stap waarin het virale RNA wordt geamplificeerd zodat het detectiesignaal - waarbij een fluorescerend molecuul vrijkomt dat oplicht onder blauw licht - helder genoeg is om te zien. Hoewel deze initiële versterking de gevoeligheid van de test verhoogt tot een vergelijkbaar niveau als qRT-PCR, het introduceert ook stappen die het moeilijker maken om de test buiten een laboratorium uit te voeren.
Het door UC Berkeley geleide team probeerde een bruikbare gevoeligheid en snelheid te bereiken zonder de eenvoud van de test op te offeren.
"Voor point-of-care toepassingen, je snel wilt reageren zodat mensen snel weten of ze besmet zijn of niet, voordat je op een vlucht stapt, bijvoorbeeld, of ga op bezoek bij familie, " zei teamleider Tina Liu, een onderzoekswetenschapper in het laboratorium van Doudna bij het Innovative Genomics Institute (IGI), een CRISPR-gericht centrum waarbij wetenschappers van UC Berkeley en UC San Francisco betrokken zijn.
Afgezien van een extra stap, een ander nadeel van initiële versterking is dat, omdat het miljarden kopieën van viraal RNA maakt, er is een grotere kans op kruisbesmetting tussen patiëntmonsters. De nieuwe techniek die door het team is ontwikkeld, draait dit om en versterkt in plaats daarvan het fluorescerende signaal, elimineren van een belangrijke bron van kruisbesmetting.
De versterkingsvrije techniek, die zij Fast Integrated Nuclease Detection In Tandem (FIND-IT) noemen, zou snelle en goedkope diagnostische tests voor veel andere infectieziekten mogelijk maken.
"Hoewel we dit project zijn begonnen met het uitdrukkelijke doel om COVID-19 te beïnvloeden, Ik denk dat deze specifieke techniek van toepassing kan zijn op meer dan alleen deze pandemie, omdat, uiteindelijk, CRISPR is programmeerbaar, " zei Liu. "Dus, je zou het CRISPR-enzym kunnen laden met een sequentie die gericht is op het griepvirus of het HIV-virus of elk type RNA-virus, en het systeem heeft het potentieel om op dezelfde manier te werken. Dit artikel stelt echt vast dat deze biochemie een eenvoudigere manier is om RNA te detecteren en de mogelijkheid heeft om dat RNA te detecteren in een gevoelig en snel tijdsbestek dat vatbaar zou kunnen zijn voor toekomstige toepassingen in point-of-care-diagnostiek."
De onderzoekers zijn momenteel bezig met het bouwen van een dergelijke diagnose met behulp van FIND-IT, die stappen zou omvatten om monsters te verzamelen en te verwerken en om de test uit te voeren op een compact microfluïdisch apparaat.
Gebruikmakend van tandem Cas-eiwitten
Om doelversterking uit de vergelijking te verwijderen, het team gebruikte een CRISPR-enzym - Cas13 - om eerst het virale RNA te detecteren, en een ander type Cas-eiwit, genaamd Csm6, om het fluorescentiesignaal te versterken.
Cas13 is een schaar voor algemeen gebruik voor het knippen van RNA; zodra het bindt aan zijn doelsequentie, gespecificeerd door een gids-RNA, het is klaar om een breed scala aan andere RNA-moleculen te knippen. Deze door het doelwit getriggerde snijactiviteit kan worden gebruikt om de detectie van een specifieke RNA-sequentie te koppelen aan de afgifte van een fluorescerend reportermolecuul. Echter, op zichzelf, Cas13 kan uren nodig hebben om een detecteerbaar signaal te genereren wanneer er zeer lage hoeveelheden doel-RNA aanwezig zijn.
Liu's inzicht was om Csm6 te gebruiken om het effect van Cas13 te versterken. Csm6 is een CRISPR-enzym dat de aanwezigheid van kleine RNA-ringen detecteert en wordt geactiveerd om een breed scala aan RNA-moleculen in cellen te knippen.
Om de Cas13-detectie te versterken, zij en haar collega's ontwierpen een speciaal ontworpen activatormolecuul dat wordt afgesneden wanneer Cas13 viraal RNA detecteert. Een fragment van dit molecuul kan binden aan Csm6 en het ertoe aanzetten om een helder fluorescerend molecuul uit een stuk RNA te knippen en af te geven. Normaal gesproken, het activatormolecuul wordt snel afgebroken door Csm6, waardoor de hoeveelheid fluorescerend signaal dat het kan genereren wordt beperkt. Liu en haar collega's bedachten een manier om de activator chemisch te modificeren, zodat deze wordt beschermd tegen afbraak en Csm6 kan superchargen om herhaaldelijk fluorescerende moleculen die aan RNA zijn gekoppeld te knippen en vrij te geven. Dit resulteert in een gevoeligheid die 100 keer beter is dan de originele activator.
"Als Cas13 wordt geactiveerd, het klieft deze kleine activator, een segment verwijderen dat het beschermt, " zei Liu. "Nu het bevrijd is, het kan veel verschillende moleculen van dat tweede enzym activeren, Csm6. En dus, één doelwit dat door Cas13 wordt herkend, leidt niet alleen tot activering van zijn eigen RNA-snijdend vermogen; het leidt tot de aanmaak van veel meer actieve enzymen die elk nog meer fluorescerende verslaggevers kunnen klieven."
Het team van onderzoekers heeft ook een geoptimaliseerde combinatie van gids-RNA's ingebouwd die een gevoeligere herkenning van het virale RNA door Cas13 mogelijk maakt. Toen dit werd gecombineerd met Csm6 en zijn activator, het team kon in slechts 20 minuten tot 31 kopieën per microliter SARS-CoV-2-RNA detecteren.
De onderzoekers voegden ook geëxtraheerd RNA uit patiëntmonsters toe aan de FIND-IT-assay in een microfluïdische cartridge, om te zien of deze test kan worden aangepast om op een draagbaar apparaat te worden uitgevoerd. Met behulp van een klein apparaat met een camera, ze konden SARS-CoV-2-RNA detecteren dat is geëxtraheerd uit patiëntmonsters met een gevoeligheid die COVID-19-infecties op hun hoogtepunt zou opvangen.
"Deze tandem-nucleasebenadering - Cas13 plus Csm6 - combineert alles in een enkele reactie bij een enkele temperatuur, 37 graden Celsius, dus het vereist geen verwarming op hoge temperatuur of meerdere stappen, zoals nodig is voor andere diagnostische technieken, " zei Liu. "Ik denk dat dit mogelijkheden biedt voor snellere, eenvoudigere tests die een vergelijkbare gevoeligheid kunnen bereiken als andere huidige technieken en mogelijk in de toekomst nog hogere gevoeligheden kunnen bereiken."
De ontwikkeling van deze amplificatievrije methode voor RNA-detectie was het gevolg van een heroriëntatie van het onderzoek binnen IGI toen de pandemie begon in de richting van problemen met de diagnose en behandeling van COVID-19. uiteindelijk, vijf laboratoria aan UC Berkeley en twee laboratoria aan UCSF raakten betrokken bij dit onderzoeksproject, een van de vele binnen de IGI.
“Toen we hiermee begonnen, we hoopten iets te creëren dat pariteit bereikte met PCR, maar had geen versterking nodig - dat zou de droom zijn, " zei Savage, die hoofdonderzoeker was voor het project. "En vanuit een gevoeligheidsperspectief, we hadden een gat van ongeveer tienduizend keer om te springen. We hebben het ongeveer duizendvoudig gemaakt; we hebben het ongeveer drie ordes van grootte verlaagd. Dus, we zijn er bijna. Vorige april, toen we het echt in kaart gingen brengen, dat leek bijna onmogelijk."
 Er is een wereldwijde toiletrevolutie aan de gang, maar het vervuilt het water en negeert de stedelijke armen
Er is een wereldwijde toiletrevolutie aan de gang, maar het vervuilt het water en negeert de stedelijke armen Aan het Victoriameer, een groene vlek verspreidt zich over het blauwe hart van Afrika
Aan het Victoriameer, een groene vlek verspreidt zich over het blauwe hart van Afrika De schaaldieren ter wereld worden bedreigd naarmate onze oceanen zuurder worden
De schaaldieren ter wereld worden bedreigd naarmate onze oceanen zuurder worden Datamining gebruiken om klimaatverandering te begrijpen
Datamining gebruiken om klimaatverandering te begrijpen Het is heel goed mogelijk om de opwarming van de aarde te beperken tot 1,5 graad
Het is heel goed mogelijk om de opwarming van de aarde te beperken tot 1,5 graad
Hoofdlijnen
- Hoe een diercelmodel te maken
- Lokale elektrische reacties in bladeren maken fotosynthese hittetolerant
- Tandwortelpulp wordt een rijke bron van stamcellen
- Hoe planten hun zaden vormen
- Gemuteerd kikkergen stoot roofdieren af
- Monstervissen van de diepte
- Wetenschappers bewerken vlindervleugelvlekken en strepen
- Hoe werken Mexicaanse springbonen?
- Een nieuwe regulator van de handel in blaasjes in planten
- Hoe u hydroxide-ionenconcentratie vindt

- Machine-learning maakt een voorheen ongeziene kijk op polymeren die nuttig zijn op biomedisch gebied mogelijk

- Nieuwe gel verhoogt celoverleving in beschadigd hersenweefsel
- Vouwende eiwitten voelen de hitte, en koud
- Moleculen zetten zichtbaar licht om in ultraviolet licht met een recordrendement

 Hoe de gele baars vis spawn?
Hoe de gele baars vis spawn?  Gemeenschappelijke spinnen in Zuid-Afrika
Gemeenschappelijke spinnen in Zuid-Afrika  Onderzoekers verbeteren de productie van textielcomposiet
Onderzoekers verbeteren de productie van textielcomposiet Opgroeien:onderzoekers creëren nieuwe gelvormende techniek die de manier waarop levende weefsels groeien nabootst
Opgroeien:onderzoekers creëren nieuwe gelvormende techniek die de manier waarop levende weefsels groeien nabootst Biologen ontdekten de paden van groepen van de lophopoor
Biologen ontdekten de paden van groepen van de lophopoor Drone-normen krijgen een eerste en blijvende knipoog als handige gids
Drone-normen krijgen een eerste en blijvende knipoog als handige gids Kiezers hebben een hoge tolerantie voor politici die liegen, zelfs degenen die het doen
Kiezers hebben een hoge tolerantie voor politici die liegen, zelfs degenen die het doen Exploderende experimenten voor kinderen
Exploderende experimenten voor kinderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

