
Wetenschap
Wat is een product van het elektrolyserwater dat KNO3 met een lage concentratie bevat?
Hier is een uitsplitsing van het proces:
* elektrolyse: Dit is het proces van het gebruik van elektriciteit om een niet-spontane chemische reactie aan te sturen. In dit geval splitsen we watermoleculen (H2O) in hun samenstellende elementen.
* kathode: De negatief geladen elektrode waar reductie optreedt. Hier worden watermoleculen elektronen en worden gereduceerd tot waterstofgas:
2H2O + 2E- → H2 + 2OH-
* anode: De positief geladen elektrode waar oxidatie optreedt. Hier verliezen watermoleculen elektronen en worden geoxideerd tot zuurstofgas:
2H2O → O2 + 4H + + 4E-
De aanwezigheid van KNO3 speelt een sleutelrol:
* elektrolyt: KNO3 werkt als een elektrolyt, waardoor de stroomstroom door de oplossing kan worden. Zonder dat zou het water een zeer lage geleidbaarheid hebben en zou de elektrolyse inefficiënt zijn.
* Geen zijreacties: De lage concentratie van KNO3 zorgt ervoor dat de primaire reactie de elektrolyse van water is. De nitraationen (NO3-) van KNO3 zijn niet betrokken bij de reactie en blijven in de oplossing.
Daarom zijn de belangrijkste producten van de elektrolyse waterstofgas en zuurstofgas. De KNO3 blijft opgelost in het water, hoewel de concentratie ervan enigszins kan afnemen als gevolg van de waterontleding.
 Buitenaardsen? laseren? Water? Wat zorgde ervoor dat de Al Naslaa-rots zo precies werd gespleten?
Buitenaardsen? laseren? Water? Wat zorgde ervoor dat de Al Naslaa-rots zo precies werd gespleten? Waarom zijn herfstbladeren rood in Amerika en geel in Europa?
Waarom zijn herfstbladeren rood in Amerika en geel in Europa?  Vroegere diepwaterdynamiek in de westelijke tropische Stille Oceaan
Vroegere diepwaterdynamiek in de westelijke tropische Stille Oceaan Noem de moeilijkste en zachtste stoffen die zich voordoen in de natuur?
Noem de moeilijkste en zachtste stoffen die zich voordoen in de natuur?  Hoe de houding ten opzichte van diversiteit verandert na een terroristische aanslag
Hoe de houding ten opzichte van diversiteit verandert na een terroristische aanslag
Hoofdlijnen
- Voorspellen wat er met een dierlijke cel kan gebeuren als je hem in gedestilleerd water stopt?
- Hoe communiceren bacteriën?
- Is bacteriën een voorbeeld van protist?
- Hoeveel grote elementen vormen het levende organisme?
- Wat is zuur in het dagelijks leven?
- Leg 2 manieren uit waarop technologie wordt gebruikt op het gebied van genetica?
- Gewijzigde nucleotiden die worden gebruikt in COVID-19-vaccins werken zoals ontworpen
- Voedsel voor onze darmen:menselijke microben voeden zich met plantensuikers
- Wat zijn de bouwstenen voor eiwitten?
- Wetenschappers ontwikkelen een methode om gevaarlijk zuur industrieel afvalwater om te zetten in waardevolle hulpbronnen
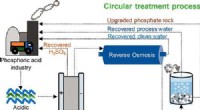
- Onderzoekers onderzoeken de invloed van schimmelrot op de aroma's van most en wijn

- Simulaties maken het mogelijk om stereochemie te kiezen voor je eigen avontuur

- Overtollig kooldioxide goed gebruiken

- Gel die afbreekt, zichzelf weer in elkaar zet kan de levering van orale medicijnen verbeteren

 Studie:Impact van landbouwactiviteiten op PM2,5 in Lombardije is vergelijkbaar met die van verstedelijking, industrie
Studie:Impact van landbouwactiviteiten op PM2,5 in Lombardije is vergelijkbaar met die van verstedelijking, industrie  Sommige zeespiegels in het verleden waren misschien niet zo hoog als gedacht, zegt studie van stijgende en dalende landmassa's
Sommige zeespiegels in het verleden waren misschien niet zo hoog als gedacht, zegt studie van stijgende en dalende landmassa's Wat ervaart een object dat op het aardoppervlak rust?
Wat ervaart een object dat op het aardoppervlak rust?  Onthullende geometrie-effecten van ruimtevaartuigen op impactsimulaties voor NASA's DART-missie
Onthullende geometrie-effecten van ruimtevaartuigen op impactsimulaties voor NASA's DART-missie Pandemie en digitalisering vormen de basis voor de heropleving van een afgedankt idee:persoonlijke koolstofrechten
Pandemie en digitalisering vormen de basis voor de heropleving van een afgedankt idee:persoonlijke koolstofrechten Nederlanders onthullen ambitieuze wet om broeikasgassen terug te dringen
Nederlanders onthullen ambitieuze wet om broeikasgassen terug te dringen Brexit:de landbrug van Ierland naar het continent verhoogt de luchtvervuiling in het VK
Brexit:de landbrug van Ierland naar het continent verhoogt de luchtvervuiling in het VK Mijn genen zorgden ervoor dat ik het deed:gedrags-genetisch bewijs voor de strafrechter
Mijn genen zorgden ervoor dat ik het deed:gedrags-genetisch bewijs voor de strafrechter
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

