
Wetenschap
Worden moleculen in gas op grote schaal verdeeld?
* Lage dichtheid: Gassen hebben een veel lagere dichtheid dan vloeistoffen en vaste stoffen. Dit betekent dat er veel lege ruimte is tussen de moleculen.
* Hoge kinetische energie: Gasmoleculen hebben een hoge kinetische energie en bewegen constant en botsen met elkaar. Deze beweging houdt ze gescheiden en voorkomt dat ze nauwe bindingen vormen.
* Zwakke intermoleculaire krachten: De aantrekkelijke krachten tussen gasmoleculen zijn erg zwak. Deze zwakke krachten laten de moleculen vrij bewegen en blijven ver uit elkaar.
Denk er op deze manier aan: Stel je een kamer vol mensen voor. Als iedereen dicht bij elkaar staat, is het als een solide. Als ze beginnen te bewegen en tegen elkaar botsen, is het als een vloeistof. Als iedereen wild rondloopt, is het als een gas, met veel ruimte ertussen.
Belangrijke opmerking: Hoewel gasmoleculen op grote schaal worden op afstand, zijn ze nog steeds constant tegen elkaar en met de wanden van hun container. Deze constante beweging geeft gassen hun vermogen om uit te breiden en alle ruimte die ze innemen te vullen.
 Waar elektronen gelijkelijk worden gedeeld, wordt de binding een wat voor soort binding genoemd?
Waar elektronen gelijkelijk worden gedeeld, wordt de binding een wat voor soort binding genoemd?  Hoe te weten hoeveel atomen aanwezig zijn in een grammonster
Hoe te weten hoeveel atomen aanwezig zijn in een grammonster Hoe beschrijf je deeltjes in een oplossing?
Hoe beschrijf je deeltjes in een oplossing?  Tot welke volgorde behoort Hydra?
Tot welke volgorde behoort Hydra?  Onderzoek naar het effect van ringsluiting op de fluorescentie van supramoleculaire polymeren
Onderzoek naar het effect van ringsluiting op de fluorescentie van supramoleculaire polymeren
 Hoe de aardewetenschap uw leven beïnvloedt?
Hoe de aardewetenschap uw leven beïnvloedt?  Koolstofuitstoot en El Nino zorgen ervoor dat de oceanen recordtemperaturen bereiken
Koolstofuitstoot en El Nino zorgen ervoor dat de oceanen recordtemperaturen bereiken  Het afschaffen van subsidies voor fossiele brandstoffen zal de CO2-uitstoot niet zoveel verminderen als gehoopt
Het afschaffen van subsidies voor fossiele brandstoffen zal de CO2-uitstoot niet zoveel verminderen als gehoopt IJsvelden in Zuid-Amerika zijn groter dan alle gletsjers in de Europese Alpen samen
IJsvelden in Zuid-Amerika zijn groter dan alle gletsjers in de Europese Alpen samen  "Life Cycle of Pythium
"Life Cycle of Pythium
Hoofdlijnen
- Een biosyntheseroute kan worden gekarakteriseerd als?
- Wat vormt een embryo?
- Wat is de juiste definitie van een model in biologieverwaarden?
- Overeenkomsten van mitose en meiose
- Wat is het doel van wetenschappelijk onderzoek?
- Op welke chromosomen zijn de dumpy- en sepia -genen in Drosophila?
- Wat is een eenvoudige neurale receptor?
- Wat zijn drie dingen die wetenschappers nucleotidesequenties gebruiken om te bepalen?
- Waarom droge massa's organismen?
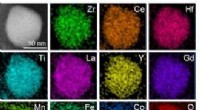
- Zwitsers zakmeskatalysator kan aardgas schoner maken
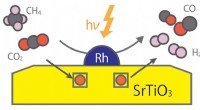
- Milieuvriendelijke katalysator voor het omzetten van methaan in bruikbare gassen met behulp van licht in plaats van warmte
- Dubbele emulsies in magere melk met minimale food-grade emulgatoren voor magere kaas

- Nieuw systeem maakt snel, antibioticabehandelingen op maat mogelijk

- Veldproeven tonen aan dat nieuw katalysatormateriaal voor elektrolysers betrouwbaar is

 Hoe het verwijderen van hotspots van hybride zonnepanelen de elektrische en thermische energie-output verbetert
Hoe het verwijderen van hotspots van hybride zonnepanelen de elektrische en thermische energie-output verbetert De planten en dieren van de kustvlakte
De planten en dieren van de kustvlakte Studie onthult meer dan 100 kleine plastics in elke maaltijd
Studie onthult meer dan 100 kleine plastics in elke maaltijd Welke planeet lijken de meest bekende extrasolaire planeten het minst op?
Welke planeet lijken de meest bekende extrasolaire planeten het minst op?  Hoe de verwijdering van de Elwha-dam de riviermonding veranderde?
Hoe de verwijdering van de Elwha-dam de riviermonding veranderde? Het gloeien van een neonlicht wordt veroorzaakt door elektronen die energie uitzenden zoals zij?
Het gloeien van een neonlicht wordt veroorzaakt door elektronen die energie uitzenden zoals zij?  Silica-paradox:wetenschappers ontdekken schijnbaar onmogelijk materiaal
Silica-paradox:wetenschappers ontdekken schijnbaar onmogelijk materiaal Opmerkelijke brief onthult aardbevingsdrama voor nonnen in ballingschap
Opmerkelijke brief onthult aardbevingsdrama voor nonnen in ballingschap
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

