
Wetenschap
Wat gebeurt er met de oplosbaarheid van water naarmate de lengte van de ketting toeneemt in carbonzuur?
* polariteit: Carbonzuren hebben een polaire carboxylgroep (-COOH) vanwege de elektronegatieve zuurstofatomen. Deze polaire groep kan waterstofbruggen vormen met watermoleculen, wat bijdraagt aan oplosbaarheid.
* Niet -polaire koolwaterstofketen: Naarmate de kettinglengte toeneemt, wordt het niet -polaire koolwaterstofgedeelte van het molecuul groter. Deze koolwaterstofketen is hydrofoob (waterrepelling) en interfereert met het vermogen van de polaire carboxylgroep om te interageren met watermoleculen.
* Hydrofoob effect: De grotere koolwaterstofketen verstoort het waterstofbindingsnetwerk in water, waardoor het energetisch ongunstig is voor het carbonzuur om op te lossen.
Samenvattend:
* Carbonzuren met korte ketens: Zijn meer oplosbaar in water vanwege het dominante effect van de polaire carboxylgroep.
* Lange kettingcarbonzuren: Word minder oplosbaar vanwege de toenemende dominantie van de niet -polaire koolwaterstofketen.
Voorbeeld:
* mierenzuur (HCOOH): Zeer oplosbaar in water vanwege zijn kleine omvang en sterke polaire interactie.
* Stearinezuur (CH3 (CH2) 16COOH): Zeer slecht oplosbaar in water vanwege de lange, niet -polaire koolwaterstofketen.
 Noorden, Zuid-Korea zet zich schrap voor sterke tyfoon vluchten stopgezet
Noorden, Zuid-Korea zet zich schrap voor sterke tyfoon vluchten stopgezet Fungiciden als onderschat gevaar voor zoetwaterorganismen
Fungiciden als onderschat gevaar voor zoetwaterorganismen Onderzoeker stelt wereldwijd waarnemingssysteem voor zeespiegelstijging voor
Onderzoeker stelt wereldwijd waarnemingssysteem voor zeespiegelstijging voor Het lot van een meer na een dramatische mijnramp
Het lot van een meer na een dramatische mijnramp Tienduizenden trekken over ruig pad om een glimp op te vangen van de IJslandse vulkaan
Tienduizenden trekken over ruig pad om een glimp op te vangen van de IJslandse vulkaan
Hoofdlijnen
- Wat is bioseksueel?
- Onderzoek suggereert dat gevaarlijke gewassenschimmel giftige chemicaliën produceert om insecten af te weren
- Het ochtendkoor horen:Okina was een nieuw akoestisch monitoringnetwerk
- NASA Twins-onderzoek wordt gerepliceerd op Everest
- Is Cho een koolhydraatlipide -eiwit of nucleïnezuur?
- Studie:hoe de hersenen uit delen een geheel maken
- Wat is het dagelijkse geplande patroon dat organismen volgen?
- Als een cel 46 chromosomen het begin van meiose heeft, dan zou er bij anafase 2 hoeveel chromosomen zijn?
- Vier potvissen sterven bij redding op strand in Indonesië
- Radiale synthese is baanbrekend voor chemisch onderzoek en productie

- Op textiel gebaseerde composieten kunnen de toekomst van lucht- en ruimtevaarttechniek weven

- Video:Kleine vuilnismensen op aarde?

- Wetenschappers ontwerpen materiaal dat energie kan opslaan als een adelaarsgreep
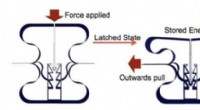
- Studie onderzoekt oxidegroei in additief vervaardigde metalen in een superkritische kooldioxide-omgeving

 Easy Atom Model for Kids Science
Easy Atom Model for Kids Science  Gegevens uit boorgaten in plaatgrenzen kunnen langzame aardbevingen verklaren
Gegevens uit boorgaten in plaatgrenzen kunnen langzame aardbevingen verklaren Een nieuwe wiskundige benadering om zeolieten te begrijpen
Een nieuwe wiskundige benadering om zeolieten te begrijpen Een jonge ster die zich vormt als een planeet
Een jonge ster die zich vormt als een planeet Wat is een gameet Wat kun je in termen van het aantal allelen voor elk gen doen over hoe gameten verschillen van andere cellen in volwassen erwtenplanten?
Wat is een gameet Wat kun je in termen van het aantal allelen voor elk gen doen over hoe gameten verschillen van andere cellen in volwassen erwtenplanten?  Openbaarmaking van klimaatgerelateerde financiële risico's niet voldoende om actie te stimuleren
Openbaarmaking van klimaatgerelateerde financiële risico's niet voldoende om actie te stimuleren Heeft de aarde een sterke of zwakke zwaartekracht?
Heeft de aarde een sterke of zwakke zwaartekracht?  Elementen die zich in hetzelfde bevinden, hebben een aantal elektronen buiten deze zo belangrijke bepalende chemische stof. Is een speciale manier om ze weer te geven geweest?
Elementen die zich in hetzelfde bevinden, hebben een aantal elektronen buiten deze zo belangrijke bepalende chemische stof. Is een speciale manier om ze weer te geven geweest?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

