
Wetenschap
Hoe kunt u een verschil gebruiken in smeltpunten (vriespunten) om de oplossing van twee vloeistoffen te scheiden?
1. De oplossing afkoelen: Begin met het koelen van de oplossing onder het vriespunt van de vloeistof met het hogere smeltpunt. Hierdoor zal dat vloeistof stollen (kristalliseren) terwijl de andere vloeistof in de vloeibare toestand blijft.
2. scheiding: U kunt nu de vaste kristallen scheiden van de resterende vloeistof door filtratie, decantatie of andere geschikte methoden. De vaste kristallen zullen meestal puur zijn, bestaande uit de vloeistof met het hogere smeltpunt.
3. herkristallisatie (optioneel): De verkregen vaste kristallen kunnen verder worden gezuiverd door herkristallisatie. Dit omvat het oplossen van de kristallen in een kleine hoeveelheid oplosmiddel (meestal hetzelfde oplosmiddel als de oorspronkelijke oplossing), het verwarmen van de oplossing om alle kristallen op te lossen en vervolgens langzaam te laten afkoelen. Terwijl de oplossing afkoelt, zullen de kristallen zich opnieuw vormen, maar deze keer met een hogere mate van zuiverheid.
Belangrijke overwegingen:
* significant smeltpuntverschil: Deze methode werkt het beste wanneer er een aanzienlijk verschil is in de smeltpunten van de twee vloeistoffen. Hoe groter het verschil, hoe gemakkelijker het is om de componenten te scheiden.
* Oplosbaarheid: De oplosbaarheid van de twee vloeistoffen in elkaar kan ook de effectiviteit van fractionele kristallisatie beïnvloeden. Als de vloeistoffen sterk oplosbaar zijn, kan scheiding moeilijker zijn.
* kristallisatieomstandigheden: Factoren zoals koelsnelheid, gebruikte oplosmiddel en onzuiverheden in de oplossing kunnen allemaal de vorming en zuiverheid van de kristallen beïnvloeden.
Voorbeeld:
Stel je voor dat je een oplossing van water en ethanol hebt. Water heeft een veel hoger smeltpunt (0 ° C) dan ethanol (-114 ° C). Door de oplossing te koelen tot een temperatuur onder 0 ° C maar boven -114 ° C, zal water bevriezen terwijl ethanol vloeibaar blijft. U kunt vervolgens de ijskristallen scheiden van de ethanoloplossing.
Opmerking: Fractionele kristallisatie is het meest effectief voor het scheiden van vaste-vloeistofmengsels, geen vloeistof-vloeistofmengsels. In het geval van vloeistof-vloeistofmengsels is destillatie vaak een geschiktere techniek.
 29 Een advertentie voor een cosmetisch poeder beweert dat het product vrij van chemicaliën is. Leg uit waarom dit onmogelijk is?
29 Een advertentie voor een cosmetisch poeder beweert dat het product vrij van chemicaliën is. Leg uit waarom dit onmogelijk is?  Hoeveel elektronen zijn aanwezig buiten de kern van het zuurstofatoom?
Hoeveel elektronen zijn aanwezig buiten de kern van het zuurstofatoom?  Als een oplosmiddel uit de oplossing verdampt, blijft de concentratie hetzelfde?
Als een oplosmiddel uit de oplossing verdampt, blijft de concentratie hetzelfde?  Hoe noem je een koolzuurhoudend drankje dat de toonkracht en de functie van een orgel verbetert?
Hoe noem je een koolzuurhoudend drankje dat de toonkracht en de functie van een orgel verbetert?  Gecontroleerde faagtherapie kan zich richten op medicijnresistente bacteriën en tegelijkertijd mogelijke onbedoelde gevolgen omzeilen
Gecontroleerde faagtherapie kan zich richten op medicijnresistente bacteriën en tegelijkertijd mogelijke onbedoelde gevolgen omzeilen
 Welke vogels zijn pinguïns die het meest verwant zijn met?
Welke vogels zijn pinguïns die het meest verwant zijn met?  La Niña zal ons een natte zomer bezorgen. Dat is geweldig weer voor muggen
La Niña zal ons een natte zomer bezorgen. Dat is geweldig weer voor muggen Studie koppelt chocoladeproductie aan toegenomen ontbossing in arme landen
Studie koppelt chocoladeproductie aan toegenomen ontbossing in arme landen Nieuwe tool voor het beoordelen van de voordelen, risico's en duurzaamheid van de visconsumptie
Nieuwe tool voor het beoordelen van de voordelen, risico's en duurzaamheid van de visconsumptie Earths 2017 resource budget besteed tegen 2 augustus:rapport
Earths 2017 resource budget besteed tegen 2 augustus:rapport
Hoofdlijnen
- Kan Nieuw-Zeeland de nationale beschermingsinspanningen ter bestrijding van plaagzoogdieren coördineren?
- Wat is het deel van het systeem dat alle levensvormen omvat?
- Waar is exedrine van gemaakt?
- Hoe werken het ademhalings- en cardiovasculaire systeem samen?
- Een mutatie is een verandering in DNA -sequentie en wat?
- Met welke organismen interageren kwallen?
- Wat denkt jouw hond? Hersenscans onthullen hondengeheimen in Emory-onderzoek
- Welk type weefselontwikkeling bestaat er in niet-vasculaire planten?
- Wat is het systeem voor het benoemen van organismen waarin elk organisme een unieke tweedelige wetenschappelijke naam kreeg?
- Stabiele perovskiet-LED's een stap dichterbij

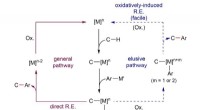
- Wetenschappers bereiken arylering van C-H-bindingen in milde omstandigheden
- Het doorbreken van de mal:een ongebruikelijke materiaalkeuze levert batterijen met een ongelooflijk lange levensduur op

- Een solide weg naar waterstofopslag
- Kleurafstembare, zeer mobiele emitterende organische eenkristallen voor lichtemitterende transistors

 Olielozingen hebben gevolgen voor het Canadese noordpoolgebied, het milieu en de inheemse volkeren
Olielozingen hebben gevolgen voor het Canadese noordpoolgebied, het milieu en de inheemse volkeren In Ivoorkust, wereldwijde rubberovervloed vernietigt winst
In Ivoorkust, wereldwijde rubberovervloed vernietigt winst NASA ziet vorm van Atlantische tropische depressie in het late seizoen
NASA ziet vorm van Atlantische tropische depressie in het late seizoen Wat is 30 nanoseconden in wetenschappelijke notatie?
Wat is 30 nanoseconden in wetenschappelijke notatie?  Beeldvorming met één molecuul laat zien hoe myosine beweegt om spiercontractie te bewerkstelligen
Beeldvorming met één molecuul laat zien hoe myosine beweegt om spiercontractie te bewerkstelligen  Grafeenspons helpt lithiumzwavelbatterijen nieuw potentieel te bereiken
Grafeenspons helpt lithiumzwavelbatterijen nieuw potentieel te bereiken Wat is het verschil tussen een chemische reactie en product in vergelijking?
Wat is het verschil tussen een chemische reactie en product in vergelijking?  Onderzoekers onderzoeken enzymactiviteiten op basis van nanocomplexsensoren
Onderzoekers onderzoeken enzymactiviteiten op basis van nanocomplexsensoren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

