
Wetenschap
Als u begint met 32 gram CH4 en deze reageert O2 om 88 CO2 72 H2O te vormen. Hoeveel werd er in geconsumeerd?
1. Schrijf de gebalanceerde chemische vergelijking:
Ch₄ + 2o₂ → co₂ + 2h₂o
2. Bereken de molaire massa van elke verbinding:
* Ch₄:(12.01 g/mol) + (4 * 1.01 g/mol) =16,05 g/mol
* O₂:(2 * 16.00 g/mol) =32,00 g/mol
* Co₂:(12.01 g/mol) + (2 * 16.00 g/mol) =44.01 g/mol
* H₂o:(2 * 1.01 g/mol) + (16,00 g/mol) =18,02 g/mol
3. Bepaal de mol CH₄:
* Mol ch₄ =(32 g) / (16,05 g / mol) =2 mol
4. Gebruik de molverhouding van de gebalanceerde vergelijking om de mol O₂ geconsumeerd te vinden:
* Uit de evenwichtige vergelijking reageert 1 mol ch₄ met 2 mol o₂.
* Mol o₂ =2 mol ch₄ * (2 mol o₂ / 1 mol ch₄) =4 mol o₂
5. Bereken de massa van O₂ geconsumeerd:
* Massa van o₂ =(4 mol) * (32,00 g/mol) =128 g
Daarom werd 128 gram o₂ in de reactie geconsumeerd.
 Wat is zwaveldhexachloride?
Wat is zwaveldhexachloride?  Alle sulfaatmineralen bevatten de elementen?
Alle sulfaatmineralen bevatten de elementen?  Samenwerking levert veelbelovende innovatie op in vlekbestendigheid
Samenwerking levert veelbelovende innovatie op in vlekbestendigheid FeCo-selenide - een mogelijk materiaal van de volgende generatie voor apparaten voor energieopslag
FeCo-selenide - een mogelijk materiaal van de volgende generatie voor apparaten voor energieopslag Wat zijn de beschuldigingen op natriumion en chloride nadat ze gecombineerd zijn?
Wat zijn de beschuldigingen op natriumion en chloride nadat ze gecombineerd zijn?
Hoofdlijnen
- Wat is de naam van kleverige witte dingen in een cel?
- Komt de bio -synthese van ribosomale subeenheden voor in kern?
- Onderzoek onthult geheimen van de ratrace van inheemse knaagdieren naar nieuwe landen
- Wat is de microscopische ruimte die tussen zenuwcellen bestaat?
- Wat is de voortbeweging van een Euglena?
- Wat is een gameet Wat kun je in termen van het aantal allelen voor elk gen doen over hoe gameten verschillen van andere cellen in volwassen erwtenplanten?
- Lab kweekt modulaire materialen op macroschaal uit bacteriën
- Stadsmuis of landmuis? Bioloog verzamelt muizen uit huizen om te onderzoeken hoe ze zo goed zijn geworden in het leven in de stad
- Welke term definieert een proces dat de gemiddelde eigenschappen van een organisme vermeldt?
- Oppervlakte-oxygenaatsoorten verbeteren de door kobalt gekatalyseerde Fischer-Tropsch-synthese

- Niet alleen brood en bier:microben kunnen koolstofdioxide fermenteren om ook brandstof te maken
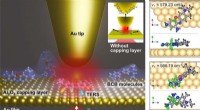
- Voor het eerst het verschil in structurele dynamiek van 1 nm enkelvoudige moleculen bij kamertemperatuur waarnemen
- Hoe de kegelslak dodelijk gif ons kan helpen betere medicijnen te maken

- De duikklokspin nabootsen om de omzetting van koolstof in brandstoffen te verbeteren

 Hoe doorlatendheid te berekenen
Hoe doorlatendheid te berekenen COSINE-100-experiment onderzoekt mysterie van donkere materie
COSINE-100-experiment onderzoekt mysterie van donkere materie Voorbeelden van archaebacteriën met hun wetenschappelijke naam en classificatie
Voorbeelden van archaebacteriën met hun wetenschappelijke naam en classificatie Monsanto moet 2 miljard dollar betalen in laatste Roundup-aanval
Monsanto moet 2 miljard dollar betalen in laatste Roundup-aanval Tests uitgevoerd op drone-oplossing voor levering van multiplex
Tests uitgevoerd op drone-oplossing voor levering van multiplex Hoe dashcams forensisch onderzoek helpen en hinderen
Hoe dashcams forensisch onderzoek helpen en hinderen Onder druk van China, Apple trekt protest-app Hong Kong in
Onder druk van China, Apple trekt protest-app Hong Kong in Welk alkalisch aardmetaal is radioactief?
Welk alkalisch aardmetaal is radioactief?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

