
Wetenschap
Welke binding wordt gevormd door het delen van elektronen tussen atomen die niet verschillen in hun elektronegativiteiten?
Dit is waarom:
* elektronegativiteit: Elektronegativiteit is het vermogen van een atoom om elektronen naar zichzelf aan te trekken in een chemische binding.
* Polaire covalente binding: Wanneer atomen een significant verschil hebben in elektronegativiteit, worden de elektronen ongelijk gedeeld. Dit creëert een gedeeltelijke positieve lading op het ene atoom en een gedeeltelijke negatieve lading aan het andere, wat resulteert in een polaire binding.
* Niet -polaire covalente binding: Wanneer atomen vergelijkbare of gelijke elektronegativiteiten hebben, worden de elektronen gelijk gedeeld. Er is geen scheiding van lading en de obligatie wordt als niet -polair beschouwd.
Voorbeelden van niet -polaire covalente bindingen:
* h-h (waterstofgas)
* Cl-Cl (chloorgas)
* o =o (zuurstofgas)
 Hoe te weten of een element een isotoop is?
Hoe te weten of een element een isotoop is?  Onderzoekers rapporteren efficiënte platformtechnologie voor de productie van cefalosporine-antibiotica
Onderzoekers rapporteren efficiënte platformtechnologie voor de productie van cefalosporine-antibiotica Zijn mengsels of isotopen atomen van hetzelfde element met verschillende aantallen neutronen?
Zijn mengsels of isotopen atomen van hetzelfde element met verschillende aantallen neutronen?  De zoektocht naar een betere zonnebrand
De zoektocht naar een betere zonnebrand Microbiële brandstofcel zet methaan om in elektriciteit
Microbiële brandstofcel zet methaan om in elektriciteit
Hoofdlijnen
- Differentiëren de twee soorten wetenschap?
- Kunnen milieutoxines de biologische klok verstoren?
- De mitochondria is de site van?
- Onderzoekers tonen aan dat de besmetting met pesticiden verder gaat dan alleen de schil van de appel
- Wat is een gemeenschappelijke naam voor prokaryoten?
- Weten wat je moet bewaren en weggooien:hoe een enzym cellulaire berichten onderscheidt
- Fatale hechting:hoe pathogene bacteriën zich aan het slijmvlies hechten en afschilfering voorkomen
- Wat gebeurt er met DNA als gevolg van mutatie?
- Ouders van het jaar:Opruimende roofvogels tonen een hoog niveau van samenwerking bij het grootbrengen van kuikens
- Onderzoek toont aan dat flerovium het meest vluchtige metaal is in het periodiek systeem
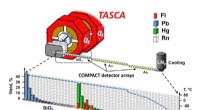
- Maak een sprong voorwaarts in de ontdekking en ontwikkeling van nieuwe antibiotica

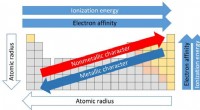
- Het periodiek systeem begrijpen door de lens van de vluchtige Groep I metalen
- Ze oprollen:organische moleculen synthetiseren met een lange spiraalvormige structuur

- Gips dat in de mond blijft plakken, kan de behandeling van orale aandoeningen verbeteren
 Kun je later in je leven ambidexter worden? Het hangt ervan af
Kun je later in je leven ambidexter worden? Het hangt ervan af  Hoe u de beste meteorenzwermen van 2010 kunt zien:hulpmiddelen, tips en 'save dates'
Hoe u de beste meteorenzwermen van 2010 kunt zien:hulpmiddelen, tips en 'save dates'  Amazons plastic afval kan de wereldbol 500 keer omcirkelen, rapport zegt
Amazons plastic afval kan de wereldbol 500 keer omcirkelen, rapport zegt Sneeuwman in de verre ruimte ontsluit het mysterie van hoe sommige slapende objecten in de diepe ruimte ijsbommen worden
Sneeuwman in de verre ruimte ontsluit het mysterie van hoe sommige slapende objecten in de diepe ruimte ijsbommen worden  Wat is grotere 1,9 decimeters of 1900 millimeter?
Wat is grotere 1,9 decimeters of 1900 millimeter?  Woningen renoveren om energielabels te verbeteren en uitstoot te verminderen
Woningen renoveren om energielabels te verbeteren en uitstoot te verminderen Wat zijn planten met buisachtige structuren waardoor water en voedingsstoffen vanaf de wortels naar beneden kunnen reizen?
Wat zijn planten met buisachtige structuren waardoor water en voedingsstoffen vanaf de wortels naar beneden kunnen reizen?  Wat was de datum van de laatste Apollo Moon -missie?
Wat was de datum van de laatste Apollo Moon -missie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

