
Wetenschap
Hoeveel niet -bindingsparen zijn er in CL4?
Dit is waarom:
* chloor (Cl) bevindt zich in groep 17 (VIIA) van de periodieke tabel, wat betekent dat het 7 valentie -elektronen heeft.
* Om een stabiel octet te bereiken, heeft chloor nog een elektron nodig.
* In een hypothetisch CL₄ -molecuul zou elk chlooratoom worden gebonden aan drie andere chlorines, waardoor een tetraëdrische structuur wordt gevormd. Dit zou elk chlooratoom achterlaten met slechts 3 bindingen en 4 niet-bindende elektronen (2 eenzame paren).
* Deze opstelling is echter zeer onstabiel . De afstoting tussen de enige paren en de bindparen zou het molecuul extreem reactief maken.
In plaats van CL₄ denk je misschien aan CL₂ (chloorgas), die bestaat als een diatomisch molecuul met één eenzaam paar op elk chlooratoom.
 Wetenschappers ontdekken hoe vloeibaar een vloeistof kan zijn
Wetenschappers ontdekken hoe vloeibaar een vloeistof kan zijn  Hoe te berekenen Mollen uit moleculair gewicht
Hoe te berekenen Mollen uit moleculair gewicht  On-the-fly analyse van hoe katalysatoren veranderen tijdens reacties om de prestaties te verbeteren
On-the-fly analyse van hoe katalysatoren veranderen tijdens reacties om de prestaties te verbeteren Hoeveel componenten zijn er in zout en water wanneer gecombineerd?
Hoeveel componenten zijn er in zout en water wanneer gecombineerd?  Wat moet je nooit met een chemische stof doen?
Wat moet je nooit met een chemische stof doen?
 Hoe maak je een ecosysteem met een schoenendoos
Hoe maak je een ecosysteem met een schoenendoos  Alles bij elkaar genomen, houten pallets zijn milieuvriendelijker dan plastic pallets
Alles bij elkaar genomen, houten pallets zijn milieuvriendelijker dan plastic pallets 'S Werelds grootste terrestrische koolstofputten zijn te vinden in jonge bossen
'S Werelds grootste terrestrische koolstofputten zijn te vinden in jonge bossen Zijn er roze flamingo's in Hawaï?
Zijn er roze flamingo's in Hawaï?  Oudere bossen verzetten zich tegen verandering - klimaatverandering, dat is
Oudere bossen verzetten zich tegen verandering - klimaatverandering, dat is
Hoofdlijnen
- Hoe worden een waarneembare eigenschappen genoemd?
- Welk plantenhormoon is verantwoordelijk voor de meeste tropismen?
- Noem de twee soorten endoplasmatisch reticulum?
- Hoe worden enzym meestal genoemd?
- Hoe virussen hun gastheercellen te slim af zijn
- Hoe vergelijkende morfologie ondersteunt de evolutietheorie?
- Wat zijn vier theorieën die de oorsprong van een staat verklaren?
- Wat baseren biologen hun in geloof evolutietheorie?
- Wat is een protist die flagellum gebruikt om te verplaatsen?
- Nieuw inzicht in de moleculaire wapens van het plantenmicrobioom
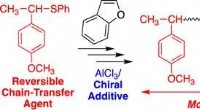
- Nieuwe milieuvriendelijke synthesemethode maakt gebruik van aluminiumoxide als recyclebare katalysator

- Tale of the tape:plakkerige stukjes zorgen voor betere batterijen

- Milieuvriendelijker, hittebestendiger en transparanter plastic maken
- Wetenschappers beschrijven het verloop van reacties in tweelaagse dunne metaalfilms

 Fotonische chips gebruiken geluidsgolven om lokale netwerken te versnellen
Fotonische chips gebruiken geluidsgolven om lokale netwerken te versnellen Op satellieten gebaseerd vroegtijdig waarschuwingssysteem voor aardbevingen getest tegen Chileense grote aardbevingen
Op satellieten gebaseerd vroegtijdig waarschuwingssysteem voor aardbevingen getest tegen Chileense grote aardbevingen nasa, NSF-expeditie om oceaankoolstof te bestuderen, begint in augustus vanuit Seattle
nasa, NSF-expeditie om oceaankoolstof te bestuderen, begint in augustus vanuit Seattle Obligaties in welke elektronen worden gelijkelijk gedeeld?
Obligaties in welke elektronen worden gelijkelijk gedeeld?  Waarom een netto-nul toekomst afhangt van het vermogen van de oceanen om koolstof te absorberen
Waarom een netto-nul toekomst afhangt van het vermogen van de oceanen om koolstof te absorberen Nieuwe inzichten in de interactie van topologische isolatoren
Nieuwe inzichten in de interactie van topologische isolatoren Experimenten met optische pincetten racen om de wetten van de kwantummechanica te testen
Experimenten met optische pincetten racen om de wetten van de kwantummechanica te testen Dwergplaneet Ceres is een oceaanwereld:studie
Dwergplaneet Ceres is een oceaanwereld:studie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

