
Wetenschap
Wat heeft het Bohr -model van Atom geholpen om uit te leggen?
* lijnspectra van atomen: Het BOHR -model legde uit waarom atomen alleen licht uitzenden bij specifieke golflengten, waardoor de karakteristieke lijnspectra werden waargenomen in experimenten. Het stelde voor dat elektronen bestaan in gekwantiseerde energieniveaus, wat betekent dat ze alleen specifieke energietoestanden kunnen bezetten. Wanneer een elektron overgaat van een hoger energieniveau naar een lagere, brengt het energie vrij in de vorm van licht met een specifieke golflengte.
* stabiliteit van atomen: Het Bohr -model gaf een verklaring voor de stabiliteit van atomen. Het verklaarde dat elektronen in specifieke banen rond de kern geen energie uitstralen, in tegenspraak zijn met de klassieke fysica. Dit was een cruciale stap om te begrijpen waarom atomen niet spontaan instorten.
* Atomic radii: Het BOHR -model bood een basis voor het begrijpen van de relatieve afmetingen van verschillende atomen. Het voorspelde dat atomen met meer elektronen grotere stralen zouden hebben omdat de elektronen hogere energieniveaus verder van de kern bezetten.
* ionisatie -energieën: Het Bohr -model bood een manier om de energie te berekenen die nodig is om een elektron uit een atoom te verwijderen, bekend als de ionisatie -energie. Dit was een belangrijk aspect van het begrijpen van chemische binding en reactiviteit.
Beperkingen van het Bohr -model:
Terwijl een revolutionair model, had het Bohr -model beperkingen:
* Het verklaarde niet de spectrale lijnen van multi-elektronenatomen.
* Het kon de energieniveaus van zwaardere atomen niet nauwkeurig voorspellen.
* Het kon geen rekening houden met de fijne structuur van spectrale lijnen (kleine splitsingen in de energieniveaus).
* Het gaf geen volledige uitleg van chemische binding.
Het Bohr -model werd uiteindelijk vervangen door meer geavanceerde modellen, zoals het kwantummechanische model, dat een nauwkeuriger en uitgebreider begrip van de structuur en het gedrag van het atoom bood. Het BOHR -model blijft echter een waardevol hulpmiddel voor het begrijpen van de fundamentele principes van de atomaire structuur en voor het introduceren van de concepten van gekwantiseerde energieniveaus en elektronenbanen.
 Wat in een chemische formule vertelt hoeveel atomen van elk element eenheidsmaatschappijen worden gevonden?
Wat in een chemische formule vertelt hoeveel atomen van elk element eenheidsmaatschappijen worden gevonden?  Water helder maken na het toevoegen van kleurstoffen voor levensmiddelen
Water helder maken na het toevoegen van kleurstoffen voor levensmiddelen  Kunnen meer dan één stof dezelfde massa hebben?
Kunnen meer dan één stof dezelfde massa hebben?  Wanneer suiker wordt verwarmd voor een korte tijd dikke kleurloze vloeibare substantie gevormd Wat voor soort verandering vindt plaats?
Wanneer suiker wordt verwarmd voor een korte tijd dikke kleurloze vloeibare substantie gevormd Wat voor soort verandering vindt plaats?  Soorten metaalhardende processen
Soorten metaalhardende processen
Hoofdlijnen
- Uit onderzoek blijkt dat er minder schimmelgifstoffen aanwezig zijn in biologisch geteeld graan, vergeleken met conventioneel geteeld graan
- Hoe worden restrictie-enzymen gebruikt in de biotechnologie?
- Hoe bepaalt een bioloog of iets levend of niet-levend is?
- Wat maken waarneembare eigenschappen goed?
- Simulaties laten zien hoe de dominante SARS-CoV-2-stam zich aan de gastheer bindt en antilichamen bezwijkt
- Wat is extra wetenschap?
- Wie publiceerde de Philosophaiae Naturalis Principia Mathematica?
- Hoe planten hun symbiotische partners vinden
- We hebben allemaal contacten nodig – hoe organellen elkaar omhelzen in cellen
- Enzym-aangedreven protocellen stijgen naar de top
- Onderzoekers beeld atomaire structuur van belangrijke immuunregulator af
- Onderzoekers ontwikkelen milieuvriendelijke, 4-in-1 katalysator
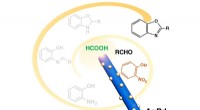
- Chemici ontwikkelen veiligere hydrogeneringsprocessen

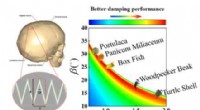
- De relatie tussen delicate hechtdraadstructuur en dempende prestaties van biomaterialen
 Wat zijn voorbeelden van concurrentie in het naaldbos?
Wat zijn voorbeelden van concurrentie in het naaldbos?  Wat is de kosmische microgolfachtergrondstraling?
Wat is de kosmische microgolfachtergrondstraling?  Hoe Australische supercomputers de cijfers hebben gekraakt om onze bosbranden en pandemische reactie te begeleiden
Hoe Australische supercomputers de cijfers hebben gekraakt om onze bosbranden en pandemische reactie te begeleiden Hoe te bepalen of een gouden ring goud is in de chemie
Hoe te bepalen of een gouden ring goud is in de chemie Wat gebeurt er met vaste stoffen en vloeistoffen bij verhitting?
Wat gebeurt er met vaste stoffen en vloeistoffen bij verhitting?  Welke planeten hebben minder dan 15 bekende satellieten?
Welke planeten hebben minder dan 15 bekende satellieten?  Rood licht voor stress:een van kleur veranderend organisch kristal
Rood licht voor stress:een van kleur veranderend organisch kristal Welke is de meest populaire maan?
Welke is de meest populaire maan?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

