
Wetenschap
Wat is de elektronenconfiguratie voor zuurstof en zwavel?
zuurstof (O):
* Volledige configuratie: 1S² 2S² 2P⁴
* stage -configuratie: [Hij] 2s² 2p⁴
zwavel (s):
* Volledige configuratie: 1S² 2S² 2P⁶ 3S² 3P⁴
* stage -configuratie: [NE] 3S² 3P⁴
Verklaring:
* Elektronenconfiguratie: Beschrijft de opstelling van elektronen in de energieniveaus en orbitalen van een atoom.
* Hoofdkwantumnummer (n): Geeft het energieniveau aan (bijv. 1, 2, 3).
* Subblevel (S, P, D, F): Geeft de vorm van het orbitaal aan.
* s: Bolvormig
* P: Stommelvormig
* d: Meer complexe vormen
* f: Nog complexere vormen
* Aantal elektronen: Het superscript geeft het aantal elektronen op dat subbloed aan.
* stage -configuratie: Gebruikt het vorige edelgas om de configuratie te vereenvoudigen.
Sleutelpunten:
* Zuurstof en zwavel bevinden zich in dezelfde groep (groep 16 of de chalcogenen). Dit betekent dat ze vergelijkbare valentie -elektronenconfiguraties hebben, wat leidt tot vergelijkbare chemische eigenschappen.
* valentie -elektronen: De buitenste elektronen (in het hoogste energieniveau) zijn verantwoordelijk voor de reactiviteit van een element. Voor zowel zuurstof als zwavel bevinden hun valentie -elektronen zich in het P -sub -niveau.
Laat het me weten als je nog andere vragen hebt over elektronenconfiguratie!
 Waarom wordt B2O3 borisch oxide genoemd?
Waarom wordt B2O3 borisch oxide genoemd?  Wat hebben mengsel en stoffen hetzelfde?
Wat hebben mengsel en stoffen hetzelfde?  Bij het meten van een kleine hoeveelheid vloeistof zou welk instrument de meest nauwkeurige lezing mogelijk maken?
Bij het meten van een kleine hoeveelheid vloeistof zou welk instrument de meest nauwkeurige lezing mogelijk maken?  Een manier om onderkoeling te overwinnen
Een manier om onderkoeling te overwinnen Waarom gehydrateerde kopersulfaatkristallen niet kunnen worden verkregen uit een oplossing door directe verwarming?
Waarom gehydrateerde kopersulfaatkristallen niet kunnen worden verkregen uit een oplossing door directe verwarming?
 Studie vindt dat giftig kwik zich ophoopt in de Arctische toendra
Studie vindt dat giftig kwik zich ophoopt in de Arctische toendra Zuurstof gekoppeld aan de opkomst en ondergang van de vroege evolutie van dieren
Zuurstof gekoppeld aan de opkomst en ondergang van de vroege evolutie van dieren Gewassen telen met stenen om CO2 te verminderen en de wereldwijde voedselzekerheid te verbeteren
Gewassen telen met stenen om CO2 te verminderen en de wereldwijde voedselzekerheid te verbeteren Koudegolf onthult potentiële voordelen van stedelijke hitte-eilanden
Koudegolf onthult potentiële voordelen van stedelijke hitte-eilanden Twee maanden op zee om de bijdrage van de Zuidelijke Oceanen aan klimaatregulering te verkennen
Twee maanden op zee om de bijdrage van de Zuidelijke Oceanen aan klimaatregulering te verkennen
Hoofdlijnen
- Waarom is UV-licht schadelijk?
- Wat zijn chemische boodschappers in de cel die de hoeveelheden geproduceerde enzym regelen?
- Wat is een allel?
- Nu kunnen onderzoekers zien hoe ongevouwen eiwitten in de cel bewegen
- Wat heeft de vorm van een peer en heeft twee genomen? Controleer de vijver
- Ambtenaren:GGO-muggen zijn geen drugs, EPA-toezicht nodig
- Hoe zou een dieren zijn extra opgeslagen suiker vrijgeven?
- Van Alaska tot Amazonia:de eerste wereldwijde kaarten met eigenschappen die de groei van vegetatie stimuleren
- Waarom zijn wetenschap en technologie belangrijk in het leven?
- Chemici synthetiseren een nieuwe hybride organisch-anorganische katalysator
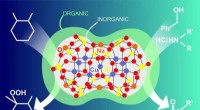
- Van lint tot scroll:vormcontrole verkrijgen door elektrostatica

- Microbiële gemeenschappen blijven gezond door kennis uit te wisselen
- Ingenieurs identificeren verbeterde membranen om CO2 af te vangen bij kolencentrales

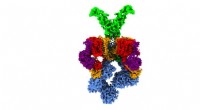
- Wetenschappers lossen 3D-structuur van nanomachine op die tuberculose virulent maakt
 Wat combineert een polymeer en monomeer correct?
Wat combineert een polymeer en monomeer correct?  EPA's IRIS-programma heeft aanzienlijke vooruitgang geboekt, zegt nieuw rapport
EPA's IRIS-programma heeft aanzienlijke vooruitgang geboekt, zegt nieuw rapport Onderzoek onthult de chemische onderbouwing van hoe goedaardig water kan veranderen in agressief waterstofperoxide
Onderzoek onthult de chemische onderbouwing van hoe goedaardig water kan veranderen in agressief waterstofperoxide  De nieuwe theorie van economische groei draagt bij aan de levensvatbaarheid van klimaatbeleid
De nieuwe theorie van economische groei draagt bij aan de levensvatbaarheid van klimaatbeleid Position paper over mogelijke effecten van klimaatverandering op wintersport
Position paper over mogelijke effecten van klimaatverandering op wintersport Hoe is de atomaire straal van bromines in vergelijking met arseen?
Hoe is de atomaire straal van bromines in vergelijking met arseen?  Waarom lost poeder beter op in heet water?
Waarom lost poeder beter op in heet water?  Hoeveel neutronen in zwavel?
Hoeveel neutronen in zwavel?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

