
Wetenschap
De drie belangrijkste soorten chemische bindingen zijn?
1. ionische bindingen: Deze bindingen vormen zich wanneer één atoom doneert een elektron naar een ander atoom, waardoor tegengesteld geladen ionen ontstaan die zich tot elkaar aangetrokken voelen. Dit komt meestal voor tussen metalen en niet -metalen. Natriumchloride (NaCl) wordt bijvoorbeeld bij elkaar gehouden door een ionische binding.
2. Covalente bindingen: Deze bindingen vormen zich wanneer twee atomen delen elektronen. Dit type binding vindt plaats tussen niet -metalen. Het watermolecuul (H2O) wordt bijvoorbeeld bij elkaar gehouden door covalente bindingen.
3. metalen bindingen: Deze bindingen vormen zich tussen metaalatomen. In een metalen binding zijn elektronen gedelokaliseerd en kan vrij door het metalen rooster bewegen, waardoor een "zee van elektronen" ontstaat. Dit verklaart waarom metalen goede geleiders van warmte en elektriciteit zijn.
Hoewel dit de drie hoofdtypen zijn, is het vermeldenswaard dat er ook andere, minder gebruikelijke soorten bindingen zijn, zoals waterstofbindingen en van der Waals -krachten. Deze worden beschouwd als zwakker dan de belangrijkste drie typen, maar spelen een belangrijke rol in biologische systemen en andere aspecten van chemie.
 Van de volgende processen in de natuur, die alleen een fysieke verandering inhoudt A. Een vogel verteert worm. B. fotosynthese vindt plaats blad. C. Een aardbeving veroorzaakt rockslide. D. brok ijzerertsroest.?
Van de volgende processen in de natuur, die alleen een fysieke verandering inhoudt A. Een vogel verteert worm. B. fotosynthese vindt plaats blad. C. Een aardbeving veroorzaakt rockslide. D. brok ijzerertsroest.?  Mijnbouwbedrijven zijn verplicht om ontgonnen terreinen hun natuurlijke karakter terug te geven. Maar is dat genoeg?
Mijnbouwbedrijven zijn verplicht om ontgonnen terreinen hun natuurlijke karakter terug te geven. Maar is dat genoeg? Wat betekent de beste waarde in de wetenschap?
Wat betekent de beste waarde in de wetenschap?  Astronomen vinden het meest verre sterrenstelsel met behulp van de James Webb-ruimtetelescoop
Astronomen vinden het meest verre sterrenstelsel met behulp van de James Webb-ruimtetelescoop  Wat gebeurt er naast A-68,
Wat gebeurt er naast A-68,
Hoofdlijnen
- Hoe celconcentratie te berekenen
- Bestaat er een geloofwaardige wetenschappelijke theorie die evolutie tegenspreekt?
- Waarom kan een breuk in de hoofdstam van de plant ervoor zorgen dat het sterft?
- Alpaca's bleken het enige zoogdier te zijn dat rechtstreeks de baarmoeder insemineerde
- Wetenschappers leren hoe ze een wegversperring kunnen vermijden bij het herprogrammeren van cellen
- Een biobank van omkeerbare mutante embryonale stamcellen
- Wat is het verschil in DNA tussen ouderoproep en dochtercellen?
- Hoe chimere, druppelvormende eiwitten kunnen bijdragen aan kanker
- Hoe plant een shorea zich voort?
- Onderzoek vindt dat mechanisch aangedreven chemie reacties in explosieven versnelt

- Kunstmatige intelligentie identificeert optimale materiaalformule

- Moleculen bouwen zoals Tinkertoys? Een doorbraakstudie kan de weg effenen
- De geur van oude boeken zou kunnen helpen ze te bewaren

- Zullen cyborgs gemaakt worden van melanine? Pigmentdoorbraak maakt biocompatibele elektronica mogelijk
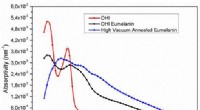
 Hoe bereiken ionische en covalente stabiliteit?
Hoe bereiken ionische en covalente stabiliteit?  Onderzoekers vinden fout in WhatsApp
Onderzoekers vinden fout in WhatsApp Wat gebeurt er als katten dik worden? Wetenschappers wegen mee
Wat gebeurt er als katten dik worden? Wetenschappers wegen mee  Het regelen van warmte opent de deur voor verlichting en displays van de volgende generatie in perovskiet-LED's
Het regelen van warmte opent de deur voor verlichting en displays van de volgende generatie in perovskiet-LED's Is het onmogelijk voor een element om atomen van anothesen in een compound te vervangen?
Is het onmogelijk voor een element om atomen van anothesen in een compound te vervangen?  Waar anders in het zonnestelsel kunt u zure regen vinden?
Waar anders in het zonnestelsel kunt u zure regen vinden?  Hoe wordt de kunst van het maken van metalen pot genoemd?
Hoe wordt de kunst van het maken van metalen pot genoemd?  Wat is het circonfrence van de aarde?
Wat is het circonfrence van de aarde?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

