
Wetenschap
Welk molecuul gehoorzaamt de octetregel CL3CF BCL3 no SBF5 Beh2?
* CL3CF: Dit molecuul is een beetje ongebruikelijk en bestaat niet in een stabiele vorm. Koolstof is in het algemeen tetravalentent (vormt vier bindingen), en het zou moeilijk zijn om een stabiel molecuul te vormen met drie chlooratomen en één fluoratoom.
* Bcl3: Boron trichloride is een klassiek voorbeeld van een molecuul dat de octetregel niet strikt gehoorzaamt . Boron heeft slechts drie valentie -elektronen en vormt drie bindingen met de chlooratomen. Dit laat boor achter met slechts 6 elektronen in zijn valentieschaal.
* nee: Stikstofoxide is een ander molecuul dat de octetregel niet gehoorzamen . Stikstof heeft 5 valentie -elektronen en zuurstof heeft 6. Ze vormen een dubbele binding, maar dit verlaat stikstof met slechts 7 elektronen.
* SBF5: Antimoon pentafluoride is een voorbeeld van een molecuul waarbij het centrale atoom zijn octet uitbreidt . Antimoon heeft 5 valentie -elektronen en vormt 5 bindingen met de fluoratomen, wat leidt tot 10 elektronen rond antimoon.
* Beh2: Berylliumhydride is een ander molecuul waar het centrale atoom de octetregel niet gehoorzaamt . Beryllium heeft slechts 2 valentie -elektronen en vormt 2 bindingen met de waterstofatomen, wat resulteert in slechts 4 elektronen rond beryllium.
Conclusie:
Geen van de vermelde moleculen die strikt worden vermeld, gehoorzaamt de octetregel. BCL3, nee en Beh2 hebben allemaal centrale atomen met minder dan 8 elektronen, terwijl SBF5 een centraal atoom heeft met meer dan 8 elektronen.
 Het begin van een revolutie in verpakkingen
Het begin van een revolutie in verpakkingen De beste vriend van een katalysator:hoe naburige atomen de elektrochemische reductie van CO₂ stimuleren
De beste vriend van een katalysator:hoe naburige atomen de elektrochemische reductie van CO₂ stimuleren  Veroorzaakt Absint echt hallucinaties?
Veroorzaakt Absint echt hallucinaties?  Plantsterkte:sleutel tot het kraken van biobrandstoffen?
Plantsterkte:sleutel tot het kraken van biobrandstoffen?  Waarom wordt chloor de chemische oplossing gebruikt om te ontsmetten?
Waarom wordt chloor de chemische oplossing gebruikt om te ontsmetten?
 Lekkage in de Oostzee-pijpleiding schaadt het leven in zee en het klimaat
Lekkage in de Oostzee-pijpleiding schaadt het leven in zee en het klimaat Gevaarlijke hitte grijpt een breed stuk van het zuiden en middenwesten aan
Gevaarlijke hitte grijpt een breed stuk van het zuiden en middenwesten aan Goede trillingen:hoe luisteren naar de geluiden van de bodem ons helpt de gezondheid van bossen te monitoren en te herstellen
Goede trillingen:hoe luisteren naar de geluiden van de bodem ons helpt de gezondheid van bossen te monitoren en te herstellen  Zouden we nog steeds zware onweersbuien hebben boven Noord-Amerika als de Golf van Mexico met land zou worden opgevuld?
Zouden we nog steeds zware onweersbuien hebben boven Noord-Amerika als de Golf van Mexico met land zou worden opgevuld? Hoe fotografie van plaats delict werkt
Hoe fotografie van plaats delict werkt
Hoofdlijnen
- Welke omstandigheden kunnen de groei van bacteriën hebben bevorderd?
- Wat is het organisme dat geen eigen voedsel kan maken en zich moet voeden met andere organismen voor energievoedingsstoffen?
- Hoeveel chromosomen worden gezien in de menselijke spermacel maar geen bloedcel?
- Hoe leren ziekteverwekkers ziekteverwekkers te zijn:partnerschappen tussen microben die leiden tot ziekte bij de mens
- Nieuw onderzoek laat zien hoe de malariaparasiet groeit en zich vermenigvuldigt
- Kaperparasiet geblokkeerd voor infiltratie van bloed
- Waarom is een voedselweb een realistischere manier om een ecosysteem af te beelden dan keten?
- Kan het beschermen van onze eiwitten ons helpen veroudering te voorkomen?
- Waar wordt het grootste deel van het glycogeen gevonden?
- Wat gebeurt er met plasmalogenen, de fosfolipiden waar niemand graag aan denkt
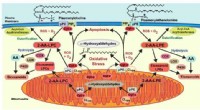
- Wetenschappers gebruiken RFID-chips om biologische monsters te volgen
- Vergelijking van de chemie van waterisomeren
- De natuur heeft meer dan één manier om methaan te maken, zeggen biochemici

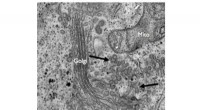
- Enzym bleek de vorming van collageendragers te beheersen en de collageenafscheiding te remmen
 Hoe worden sommige sterren vallende sterren?
Hoe worden sommige sterren vallende sterren?  Iran:decennia van niet-duurzaam watergebruik hebben meren doen opdrogen en vernietiging van het milieu veroorzaakt
Iran:decennia van niet-duurzaam watergebruik hebben meren doen opdrogen en vernietiging van het milieu veroorzaakt Hoe lang duren orchideeënbloeien? Tips voor het kweken van orchideeën
Hoe lang duren orchideeënbloeien? Tips voor het kweken van orchideeën  Hoe een opwarmend Noordpoolgebied de mondiale klimaatverandering versnelt
Hoe een opwarmend Noordpoolgebied de mondiale klimaatverandering versnelt  Licht werpen op moiré-excitons:een perspectief van de eerste beginselen
Licht werpen op moiré-excitons:een perspectief van de eerste beginselen Nieuwe CEO's kunnen hun sociale spel verbeteren om hun baan te behouden, zegt studie
Nieuwe CEO's kunnen hun sociale spel verbeteren om hun baan te behouden, zegt studie Wetenschappers identificeren weergebeurtenis achter extreme kou in Europa en Azië in februari 2018
Wetenschappers identificeren weergebeurtenis achter extreme kou in Europa en Azië in februari 2018 Team bepaalt eerste structuur met hoge resolutie van dopaminereceptor
Team bepaalt eerste structuur met hoge resolutie van dopaminereceptor
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

